Электролит: основа свинцово-кислотных автомобильных аккумуляторов
В качестве стартерных батарей в автотранспорте используются свинцово-кислотные аккумуляторы. Функционирование аккумулятора обеспечивается специальным раствором серной кислоты — электролитом. О том, что такое аккумуляторный электролит, каких типов он бывает, и как его использовать — читайте в статье.
Что такое электролит?
Аккумуляторный электролит — водный раствор серной кислоты, предназначенный для использования в свинцово-кислотных аккумуляторных батареях (АКБ). Электролит готовится путем растворения концентрированной серной кислоты в дистиллированной воде, молекулы кислоты в данном растворе диссоциируют (распадаются) на ионы — это явление наделяет электролит электропроводящими свойствами.
Аккумуляторный электролит имеет следующее назначение:
- Изготовление аккумуляторных батарей;
- Ввод в эксплуатацию сухозаряженных батарей;
- Восстановление АКБ при загрязнении или утечке электролита, коротких замыканиях между пластинами и других неисправностях.
Но прежде, чем применять электролит для той или иной цели, необходимо разобраться в его характеристиках и особенностях применения.
Зачем в аккумуляторе электролит?
Электролит, свинцовые пластины и пористый диоксид свинца (PbO2) — три основных компонента свинцово-кислотного аккумулятора. Именно в присутствии кислотного электролита протекают электрохимические реакции, делающие возможным накопление и отдачу аккумулятором электрического заряда.
Во время разряда АКБ металлический свинец и оксид свинца вступают в реакцию с серной кислотой (точнее — с ее отрицательными ионами SO4 и положительными ионами H), образуя сульфат свинца (PbSO4) и воду, при этом на анодных пластинах выделяются избыточные электроны. На катодных пластинах, напротив, наблюдается недостаток электронов, благодаря этому при замыкании анода и катода между ними возникает электрический ток.
В ходе данных реакций количество серной кислоты и воды в электролите изменяется, что приводит к изменению его плотности и объема. При разряде АКБ концентрация кислоты понижается, а концентрация воды немного увеличивается, что приводит к падению плотности и к некоторому увеличению объема электролита. В процессе заряда плотность повышается, а объем несколько понижается.
Типы и характеристики электролитов
Электролит изготавливается смешиванием концентрированной серной кислоты и дистиллированной воды в строго определенных пропорциях. Для изготовления электролита используется специальная аккумуляторная серная кислота (по ГОСТ 667-73) и дистиллированная вода (по ГОСТ 6709-72). Данный раствор используется во всех типах современных свинцово-кислотных аккумуляторов.
Главная характеристика электролита — плотность. Для нормальной работы АКБ плотность электролита должна лежать в пределах 1,23-1,4 г/куб. см, так как именно при такой плотности раствор имеет максимальную электропроводность. Однако плотность концентрированной серной кислоты составляет 1,83 г/куб. см, поэтому для достижения необходимой плотности кислота смешивается с водой.
Плотность электролита в значительной степени зависит от двух параметров: температуры и степени заряда аккумулятора.
О зависимости плотности электролита в зависимости от заряда АКБ мы сказали выше: при заряде плотность повышается, при разряде — понижается. Зависимость плотности электролита от температуры простая: при снижении температуры плотность падает, при повышении — возрастает. Поэтому нормальная плотность определяет при температуре +25°C, а чтобы верно измерять плотность при любой температуре, используют таблицу поправок к показаниям ареометра:
| Температура электролита, °C |
Поправка к показаниям ареометра, г/куб.  см см |
|---|---|
| -55 … -41 | -0,05 |
| -40 … -26 | -0,04 |
| -25 … -11 | -0,03 |
| -10 … +4 | -0,02 |
| +5 … +19 | -0,01 |
| +20 … +30 | 0 |
| +31 … +45 | +0,01 |
| +46 … +60 | +0,02 |
Например, если электролит при температуре +25°C имеет плотность 1,28 г/куб. см, то при температуре -15°C он имеет плотность 1,25 г/куб. см, а при нагреве до +50°C (что часто бывает в подкапотном пространстве автомобиля) плотность повышается до 1,3 г/куб. см.
Чтобы компенсировать изменение плотности электролита в АКБ транспортных средств, эксплуатируемых в различных климатических поясах, применяются электролиты большей или меньшей плотности:
- Летние и для жаркого климата — плотностью 1,23-1,24 г/куб.см;
- Для умеренного и холодного климата — 1,27-1,28 г/куб.см;
- Зимние и для холодного климата — 1,3-1,34 г/куб.см.
Кроме того, при повышении плотности электролита повышается его морозоустойчивость — более плотные электролиты устойчивы к замерзанию, поэтому они лучше подходят для эксплуатации в холодное время года и в холодных климатических поясах.
Сегодня можно купить электролит необходимой плотности, освободив себя от непростой процедуры приготовления правильного по характеристикам электролита из кислоты и воды. Электролит продается в тарах емкостью от 1 до 20 литров, поэтому всегда можно приобрести нужный для работы объем.
Использование аккумуляторного электролита
Сразу нужно отметить, что электролит не используется для текущего обслуживания аккумулятора. Наиболее часто в АКБ снижается уровень электролита и падает его уровень, в этом случае обслуживание выполняется добавлением воды. Дело в том, что в процессе работы аккумулятора из электролита испаряется вода, а кислота остается на месте. Также потеря воды может возникать в случае перезаряда аккумулятора — при достижении определенной плотности концентрация серной кислоты в электролите снижается и ее уже не хватает для нормального протекания указанных выше электролитических реакций.
Наиболее часто электролит применяется для восстановления работы аккумулятора в случае замерзания электролита с последующей потерей его характеристик. Если электролит в АКБ замерз, то, прежде всего, необходимо занести его в теплое помещение и дождаться оттаивания. После этого аккумулятор следует поставить на зарядку с малым током — рекомендуется ток около 1 ампера и срок зарядки до 2 суток. В ходе зарядки нужно измерять плотность электролита, если она начнет повышаться, то его можно нормально зарядить и эксплуатировать.
Если же ни при каких условиях плотность не повышается, то следует произвести замену электролита. Это выполняется следующим образом:
- Слить электролит из всех банок батареи;
- Промыть банки дистиллированной водой;
- Добавить новый электролит до указанного уровня;
- Оставить аккумулятор на 2-3 часа для пропитки пластин электролитов;
- Зарядить АКБ малым током 0,5-1 ампер в течение 2 суток.
Зарядку следует остановить, когда плотность электролита и напряжение на клеммах будут стабильными в течение хотя бы двух часов.
Но если замерзание аккумулятора вызвало деформацию или разрушение пластин, то менять электролит уже бесполезно — нужно покупать новую батарею.
Аналогично устраняются и другие проблемы с аккумулятором — утечка или загрязнение электролита, ремонт АКБ после короткого замыкания и т.д. Но в этих случаях прежде нужно проверить аккумулятор на целостность и ремонтопригодность, при обнаружении трещин и других физических повреждений батарея ремонту не подлежит, ее нужно утилизировать.Особый случай — ввод в эксплуатацию сухозаряженных аккумуляторов, которые поставляются без электролита. Обычно для подготовки такого аккумулятора его нужно заполнить электролитом и дождаться достижения необходимой плотности — все эти действия обязательно прописаны в инструкции к аккумулятору. Предварительную зарядку сухозаряженного АКБ проводить не нужно!
Обычно для подготовки такого аккумулятора его нужно заполнить электролитом и дождаться достижения необходимой плотности — все эти действия обязательно прописаны в инструкции к аккумулятору. Предварительную зарядку сухозаряженного АКБ проводить не нужно!
Во всех случаях необходимо правильно рассчитывать объем электролита, чтобы сделать правильную покупку. Объем электролита в АКБ зависит от его напряжения и электрической емкости. Наиболее распространенные 12-вольтовые аккумуляторные батареи емкостью 55-60 А·ч вмещают 2,5-3 литра, емкостью 75-90 А·ч — от 3,5 до 5 литров. Большие 24-вольтовые АКБ емкостью свыше 100 А·ч могут содержать 10 и более литров электролита. При покупке рекомендуется брать электролит с небольшим запасом, так как в процессе работы возможны непредвиденные потери и утечки.
Плотность электролита в аккумуляторе — какая должна быть, проверка, как повысить
Свинцово-кислотным аккумуляторам уже более полутора столетий, но позиции в автомобилестроении они не сдают и по сей день. Главных причин тому две: низкая себестоимость и морозоустойчивость. Литий-ионный аккумулятор, пускай он и гораздо компактнее и легче при сопоставимой с свинцово-кислотным емкости, но стоит в разы дороже и уже при 0° С его емкость упадет вдвое (в то время как у свинцовой батареи это произойдет только при -30° С). И это не говоря уже о гораздо большей требовательности к условиям заряда и разряда.
Необслуживаемые кальциевые и AGM-аккумуляторы завоевывают все большую популярность, но АКБ традиционной конструкции с возможностью обслуживания все так же можно увидеть под капотом автомобиля. Контроль уровня и состояния электролита увеличивает ресурс аккумулятора, а самое главное – страхует от проблем зимой, что «рукастому» владельцу только в плюс.
Принцип действия аккумулятора
Говоря о плотности аккумуляторного электролита, нужно начать с самого принципа работы автомобильных аккумуляторов. Во время заряда-разряда в аккумуляторе протекают около 60 реакций, как утверждают исследования еще советских времен,но основной из них является только одна: в процессе разряда оксид свинца на катоде (отрицательном электроде) и свинец на аноде (положительном электроде) «забирают» сульфат-ионы из раствора серной кислоты, превращаясь в сульфат свинца, причем на катоде дополнительно образуется вода, а при заряде сульфат свинца, напротив, «отдает» сульфат-ионы в электролит.
Таким образом, во время разряда плотность электролита падает, при полном разряде между пластинами фактически остается дистиллированная вода, а во время заряда она возрастает. Тогда почему падает плотность раствора в аккумуляторе со временем, если эти процессы зеркальны?
Причина в том, что сульфат свинца, образующийся при разряде аккумуляторной батареи, не всегда полностью расходуется в ходе заряда. Особенно это заметно на морозе и после длительного пребывания батареи в разряженном состоянии: пластины покрываются сначала белыми разводами крупнокристаллического сульфата свинца, а затем эти кристаллы постепенно осыпаются вниз и в дальнейшей реакции, проходящей при зарядке, практически не участвуют.
Поэтому сульфатация пластин аккумулятора является однозначно вредным явлением. Снижается емкость аккумулятора, прочность пластин, а из-за падения плотности электролита батарея хуже набирает заряд: чем ниже плотность раствора, тем хуже проводимость. Полностью разряженный аккумулятор практически не принимает заряд – сопротивление электролита между его пластинами слишком велико.
Однако плотность может со временем и вырастать. Так как электролит – это не чистая серная кислота, а ее водный раствор, то при зарядке АКБ протекает еще одна реакция: банальный электролиз воды, малозаметный в начале цикла, но к концу идущий по нарастающей. Поэтому старые рекомендации по заряду обслуживаемых АКБ советовали дождаться «кипения» аккумулятора – резкого роста выделения кислорода и водорода в банках. Теряя воду, со временем электролит снизит свой уровень, а плотность его неизбежно возрастет – даже с учетом постепенного связывания серной кислоты на пластинах и в осыпи вода при «кипении» теряется быстрее.
Нормальная плотность электролита
Чистая серная кислота в аккумуляторах не используется – это чрезмерно опасно, значительно возрастает скорость сульфатации пластин даже при нормальной эксплуатации. Из эксплуатационных соображений плотность электролита аккумулятора выбрана такой, чтобы обеспечить возможность уверенной работы при отрицательных температурах, достаточную удельную емкость и скорость заряда.
При нормальных условиях (под которыми в физике принято понимать, среди прочего, температуру +20° С) плотность электролита в полностью заряженном аккумуляторе составляет 1,28-1,3 г/см3. Как можно видеть на приведенной иллюстрации, именно такая плотность обеспечивает наибольшую морозоустойчивость. Заодно заметно, что у полностью разряженного аккумулятора риск замерзания зимой очень велик – достаточно температуре опуститься ниже -5, как в электролите образовываются кристаллики льда.
Зимняя и летняя плотность электролита
Однако на практике измерение плотности электролита в аккумуляторе при строго заданной температуре невозможно: зимой в гараже плотность у исправного и заряженного аккумулятора увеличится, а летом, да еще и сразу после поездки, напротив, будет ниже. Поэтому принята система поправок при измерениях в зависимости от температуры аккумулятора, которая отображена в таблице ниже.:
| Температура электролита, °С | Поправка, г/см3 |
| От –40 до –26 | –0,04 |
| От –25 до –11 | –0,03 |
| От –10 до +4 | –0,02 |
| От +5 до +19 | –0,01 |
| От +20 до +30 | 0,00 |
| От +31 до +45 | 0,01 |
Таким образом, если Вы измеряете плотность зимой во время легкого заморозка (до -10), то у заряженного аккумулятора она должна составлять 1,3-1,32 г/см3, так как с поправкой -0,02 мы и получим «стандартные» 1,28-1,3. На жаре же уже нормой плотности будут 1,27-1,29 г/см3.
Ещё кое-что полезное для Вас:
Порядок измерения плотности аккумулятора
Для начала аккумулятор необходимо установить на ровную горизонтальную плоскость и очистить крышку от пыли и грязи. Лучше для этого использовать ткань, смоченную слабым раствором соды, как самой доступной щелочи: она нейтрализует возможное отпотевание электролита вокруг пробок.
Теперь проверяем уровень электролита. Проще это сделать на аккумуляторах с полупрозрачными стенками – на стенках есть риски, с помощью которых можно сразу понять, находится ли уровень в пределах допустимого. Важна не только сама высота уровня, но и равномерность по банкам: там, где уровень электролита заметно меньше, возможна неисправность (негерметичность стенок или днища, быстрое «выкипание» электролита из-за его чрезмерной изначальной плотности и так далее). Если стенки у аккумулятора непрозрачные, воспользуйтесь прозрачной трубкой, опуская ее в отверстия пробок до упора в набор пластин и затыкая после этого верхний конец пальцем: вытащив трубку, Вы увидите, насколько электролит выше пластин. Нормой считается высота уровня в 10-15 мм над пластинами.
Если в какой-то банке уровень электролита ниже нормы, доведите его до нужного, аккуратно доливая дистиллированную воду. Как мы уже писали выше, чаще всего уровень снижается из-за потери воды за счет электролиза, поэтому восполнять уровень готовым электролитом нельзя.
Перед проверкой плотности обеспечьте батарее состояние стопроцентной заряженности – подсоедините зарядное устройство до момента «кипения» или до его отключения, если используете автоматическую модель. Это нужно и для того, чтобы плотность в банке выровнялась после доливания дистиллированной воды, иначе измерение даст ошибочный результат.
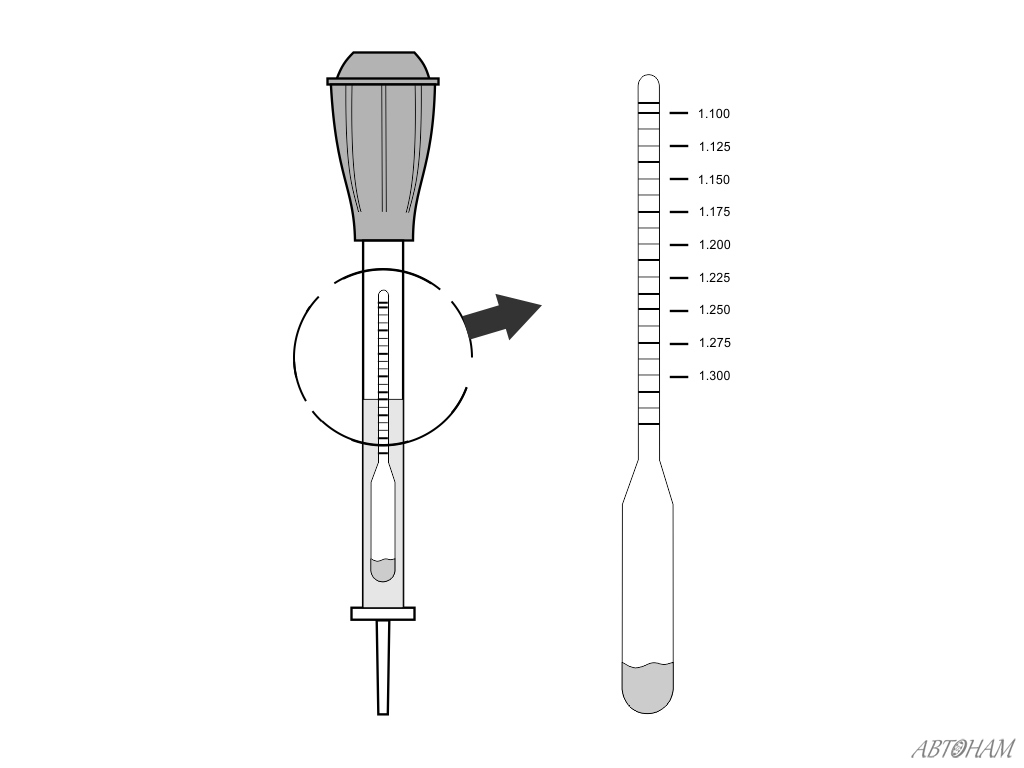
Распространенный прибор для контроля плотности – это ареометр, представляющий собой прозрачную колбу с грушей для набора жидкости. Внутри этой колбы находится грузик с делениями – в набранный электролит он погрузится на высоту, зависящую от плотности аккумулятора, и риска, по которую он погрузится, и укажет на результат измерения.
Однако есть и более удобный и универсальный прибор – речь идет об оптическом рефрактометре, который способен также измерять температуру замерзания охлаждающей жидкости и «омывайки». Для измерения достаточно капнуть на нужное место из пипетки и прижать каплю прозрачным стеклом-крышкой. Посмотрев на свет через рефрактометр, вы увидите по риске плотность электролита. Это быстрее, да и точнее, чем привычный способ с ареометром.
Посмотрев на свет через рефрактометр, вы увидите по риске плотность электролита. Это быстрее, да и точнее, чем привычный способ с ареометром.
Как повысить или понизить плотность в аккумуляторе
Как поднять плотность электролита в аккумуляторе или, наоборот, понизить ее, если измерения показали, что она выходит за пределы нормы? Сразу предупредим: придется повозиться.
Для начала нужно запастись электролитом повышенной (и заранее известной!) плотности. Для удобства возьмем электролит с плотностью 1,4 г/см3 – он достаточно безопасен при работе. Далее необходимо узнать, каков объем одной банки аккумулятора, полностью слив ее в стеклянную градуированную емкость. Отнимая некоторое количество электролита и доливая заранее запасенный «крепкий» (или, наоборот, дистиллированную воду), можно соответствующим образом довести плотность до необходимой. Ориентируйтесь на следующую таблицу для объема в 1 литр:
| Измеренная плотность | Отбор электролита, мл | Доливка электролита, мл | Доливка воды, мл |
| 1,24 | 252 | 256 | |
| 1,25 | 215 | 220 | |
| 1,26 | 177 | 180 | |
| 1,27 | 122 | 126 | |
| 1,28 | 63 | 65 | |
| 1,29 | |||
| 1,30 | 36 | 38 |
В результате вы получите 1 литр электролита с плотностью 1,29 г/см3 – эта величина находится ровно посреди допуска.
Приведем пример: из банки слилось 0,8 литра раствора с плотностью 1,24 г/см3. Из простейшей пропорции можно вычислить, что нам нужно отлить 201 мл из этого объема и добавить 204 мл «крепкого» электролита. Почему различаются объем доливки и удаляемый объем? Любой бывалый самогонщик подскажет: раствор серной кислоты в воде, как и в случае со спиртом, меняет свой объем в зависимости от процентного соотношения компонентов, и 100 мл кислоты в смеси со 100 мл воды дадут отнюдь не 200 мл раствора.
Можно ли избежать этой возни? Естественно. Раз уж вам приходится сливать электролит из банки, то гораздо быстрее сразу залить туда свежий электролит нормальной плотности. Не помешает и промыть перед этим его дистиллированной водой: это лишний плюс для ресурса батареи.
Видео: Как правильно поднять плотность электролита в аккумуляторе
Оптимальная плотность электролита! | Статьи компании ООО «KRONVUZ» г Москва
Мы часто сталкиваемся с вопросом об эксплуатации автомобильных аккумуляторов, число автовладельцев возрастает, и, конечно, весь круг автолюбителей знает, что аккумулятор не работает без электролита. Плотность данного вещества зависит от многих факторов, но принято считать, что оптимальная плотность электролита составляет 1,26 г/см3.
По плотности электролита можно установить, в каком состоянии находится батарея. В том случае, когда АКБ плохо держит заряд, нужно проверить концентрацию жидкости внутри нее. Когда батарея находится в рабочем состоянии, вода постепенно испаряется, что способствует большей концентрации электролита, а это оказывает отрицательное влияние на состояние аккумуляторной батареи.
Отрицательно влияет на АКБ как повышенная, так и пониженная плотность электролита. Излишняя плотность активирует химические процессы, протекающие в батарее постоянно. Из этого следует быстрое разрушение пластин и снижение срока службы аккумулятора.
Единой рекомендации оптимальной плотности электролита не существует, потому что его плотность зависит от критических значений температуры в определенных регионах, для каждого из которых есть свое собственное значение.
- В условиях Крайнего Севера плотность электролита должна составлять не менее 1,29 г/см3;
- Для большей части территории РФ приемлем показатель 1,26– 1,27 г/см3;
- В теплых районах нормальная плотность составляет 1,23–1,25 г/см3;
- Минимальным значением является показатель 1,23 г/см3.

Опираясь на эту статистику, можно расценивать показатель 1,26 г/см3 как оптимальный. При заливке электролита готовить раствор рекомендуется, опираясь на минимальный показатель данных диапазонов, а для щелочного аккумулятора плотность содержимого должна составлять около 1,2 г/см3.
Прибор для измерения плотности электролита называется денсиметр. Выполнить проверку плотности можно и с помощью вольтметра.
К каждой АКБ прилагается инструкция по эксплуатации, в которой описаны материалы АКБ, технология изготовления АКБ, а также, к какой категории относится данная АКБ.
Аккумуляторные батареи бывают обслуживаемыми, малообслуживаемыми (на протяжении длительного времени не требующие доливки воды) и необслуживаемые.
К сожалению, не всегда удается уследить за состоянием акб и вовремя его обслуживать. Если жидкость в аккумуляторе поменяла цвет, это значит, что упала плотность и необходимо слить и заменить электролит.
Более подробно узнать информацию об электролите и его замене можно в статье «Замена электролита в аккумуляторе».
Наша компания производит целый ряд устройств для обслуживания аккумуляторных батарей и контроля электролита. Вся продукция производства предприятия «KRONVUZ» выполнена по высоким технологиям, что способствует бесперебойной эксплуатации длительное время.
Рекомендуем ознакомиться со следующими материалами:
Плотность электролита в аккумуляторе — зимой и летом: таблица
Большая часть аккумуляторных батарей, которые продаются в России, относится к полуобслуживаемым. Это означает, что владелец может откручивать пробки, проверять уровень и плотность электролита и при необходимости доливать внутрь дистиллированную воду. Все кислотные АКБ, когда только поступают в продажу, заряжены, как правило, на 80 процентов. При покупке следите за тем, чтобы продавец выполнил предпродажную проверку, одним из пунктов которой является проверка плотности электролита в каждой из банок.
При покупке следите за тем, чтобы продавец выполнил предпродажную проверку, одним из пунктов которой является проверка плотности электролита в каждой из банок.
В сегодняшней статье на нашем портале Vodi.su мы рассмотрим понятие плотности электролита: что это такое, какой она должна быть зимой и летом, как ее повысить.
В кислотных АКБ в качестве электролита применяется раствор h3SO4, то есть серной кислоты. Плотность напрямую связана с процентным содержанием раствора — чем больше серы, тем она выше. Еще один немаловажный фактор — температура самого электролита и окружающего воздуха. Зимой плотность должна быть выше, чем летом. Если же она упадет до критической отметки, то электролит попросту замерзнет со всеми вытекающими последствиями.
Измеряется данный показатель в граммах на сантиметр кубический — г/см3. Измеряют ее при помощи простого прибора ареометра, который собой представляет стеклянную колбу с грушей на конце и поплавком со шкалой в середине. При покупке нового АКБ продавец обязан измерить плотность, она должна составлять, в зависимости от географической и климатической зоны, 1,20-1,28 г/см3. Допускается разница по банкам не более 0,01 г/см3. Если же разница больше, это свидетельствует о возможном коротком замыкании в одной из ячеек. Если же плотность одинаково низкая во всех банках, это говорит как о полном разряде батареи, так и о сульфатации пластин.
Помимо измерения плотности продавец должен также проверить, как аккумулятор держит нагрузку. Для этого применяют нагрузочную вилку. В идеале напряжение должно падать с 12 до девяти Вольт и держаться на этой отметке некоторое время. Если же оно падает быстрее, а электролит в одной из банок кипит и выделяет пар, значит от покупки этой АКБ следует отказаться.
Плотность в зимний и летний период
Более детально данный параметр для вашей конкретной модели АКБ нужно изучить в гарантийном талоне. Созданы специальные таблицы для различных температур, при которых электролит может замерзнуть. Так, при плотности 1,09 г/см3 замерзание происходит при -7°С. Для условий севера плотность должна превышать 1,28-1,29 г/см3, ведь при таком показателе температура его замерзания составляет -66°С.
Так, при плотности 1,09 г/см3 замерзание происходит при -7°С. Для условий севера плотность должна превышать 1,28-1,29 г/см3, ведь при таком показателе температура его замерзания составляет -66°С.
Плотность обычно указывают для температуры воздуха +25°С. Она должна составлять для полностью заряженной батареи:
- 1,29 г/см3 — для температур в пределах от -30 до -50°С;
- 1,28 — при -15-30°С;
- 1,27 — при -4-15°С;
- 1,24-1,26 — при более высоких температурах.
Таким образом, если вы эксплуатируете автомобиль в летний период в географических широтах Москвы или Санкт-Петербурга, плотность может быть в пределах 1,25-1,27 г/см3. Зимой же, когда температуры опускаются ниже -20-30°С, плотность повышается до 1,28 г/см3.
Обратите внимание, что “повышать” ее искусственно никак не нужно. Вы попросту продолжаете пользоваться своим автомобилем в обычном режиме. А вот если АКБ быстро разряжается, имеется смысл провести диагностику и при необходимости поставить на зарядку. В случае же, если машина долго стоит на морозе без работы, АКБ лучше снять и унести в теплое место, иначе он от длительного простоя попросту разрядится, а электролит начнет кристаллизоваться.
Практические советы по эксплуатации АКБ
Самое основное правило, которое следует запомнить, — в батарею ни в коем случае нельзя заливать серную кислоту. Повышать плотность таким образом вредно, так как при повышении активизируются химические процессы, а именно сульфатации и коррозии, и уже через год пластины станут полностью ржавыми.
Регулярно проверяйте уровень электролита и при его падении доливайте дистиллированную воду. Затем АКБ нужно либо поставить на зарядку, чтобы кислота смешалась с водой, либо зарядить АКБ от генератора во время длительной поездки.
Если машину ставите «на прикол», то есть некоторое время не используете ее, то, даже если среднесуточные температуры опускаются ниже нуля, нужно позаботиться о том, чтобы АКБ был полностью заряжен.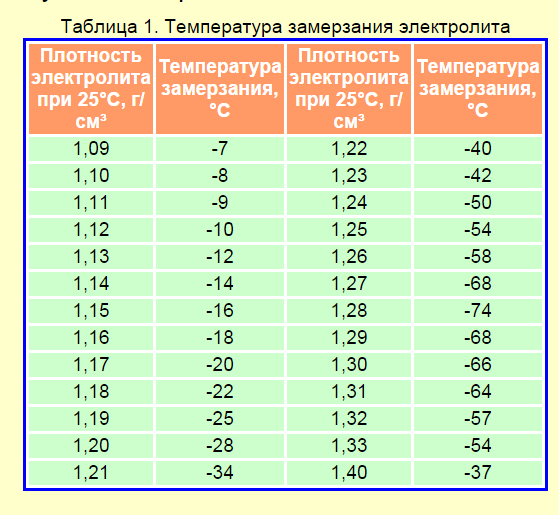 Это минимизирует риск замерзания электролита и разрушения свинцовых пластин.
Это минимизирует риск замерзания электролита и разрушения свинцовых пластин.
При падении плотности электролита увеличивается его сопротивление, из-за чего, собственно, и затруднен запуск двигателя. Поэтому прежде, чем завести мотор, прогрейте электролит, включив на некоторое время фары или другое электрооборудование. Не забывайте также проверять состояние клемм и очищать их. Из-за плохого контакта пускового тока недостаточно для создания нужного крутящего момента.
Какая должна быть плотность электролита в аккумуляторе автомобиля?
Оптимальные показатели в зависимости от времени года
Плотность является важным параметром всех аккумуляторных батарей, значение которого рекомендуется удерживать на оптимальном уровне. Такое положение объясняется двумя основными причинами. Во-первых, значение параметра зависит от периода времени, в течение которого батарея будет стабильно функционировать. Во-вторых, уровень плотности определяет качество ёмкости АКБ, которое может постепенно падать из-за неоптимальной величины параметра.
Плотность электролита в аккумуляторе равна 1,27–1,31 г/см3. Однако такие значения соответствуют норме в регионах с умеренным климатическим режимом. Если эксплуатировать автомобиль в районах, в которых температурный режим может достигать -50, то плотность электролита в АКБ там от 1,29 до 1,31 г/см3. Норма устанавливается в зависимости от климатических особенностей района и времени года.
Также у водителей может появиться вопрос, какая плотность электролита в аккумуляторе должна быть в разное время года. Проанализируем этот показатель летом и зимой.
Летом
Нормальная плотность электролита в аккумуляторе изменяется в интервале от 1,25 до 1,27 г/см3 в жаркий сезон. Но летом АКБ может работать нестабильно, так как существует вероятность возникновения проблем, связанных с потерей значительного количества жидкости.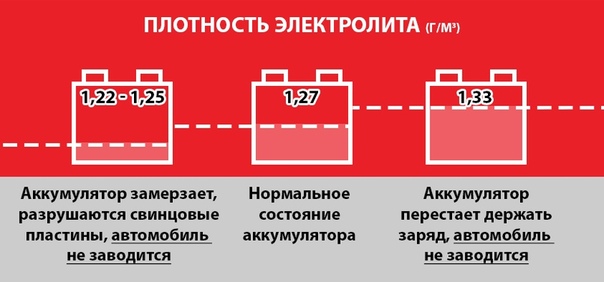 Специалисты советуют удерживать значение параметра на 0,02–0,03 г/см3 ниже оптимального. Нельзя не отметить, что данная рекомендация преимущественно относится к южным регионам нашей страны.
Специалисты советуют удерживать значение параметра на 0,02–0,03 г/см3 ниже оптимального. Нельзя не отметить, что данная рекомендация преимущественно относится к южным регионам нашей страны.
Приводим таблицу плотности электролита в аккумуляторе в летнее время.
| Регион | Величина плотности, г/см3 |
|---|---|
| Центральный | 1,27 |
| Южный | 1,25 |
| Северный | 1,27 |
| Крайний Север | 1,27 |
Зимой
Какая должна быть плотность аккумулятора в зимний сезон? Она не должна опускаться ниже 1,27 г/см3. Исключением являются южные регионы, в которых значение показателя может составлять 1,25 г/см3.
Если рассматривать районы Крайнего Севера, то плотность аккумулятора должна находиться в промежутке от 1,31 г/см3 до 1,35 г/см3. Такое положение объясняется несколькими причинами. Во-первых, если значение показателя будет слишком маленьким, то электролит внутри АКБ при крепком морозе может превратиться в ледышку, так как доля жидкости в нём в несколько раз превышает норму. Во-вторых, основные части и механизмы автотранспортного средства замерзают при минусовых температурах. Чтобы этого не произошло, необходимо усилить электродвижущую силу, с помощью которой можно осуществить запуск двигателя внутреннего сгорания. Даже современные машины не смогут это реализовать без дополнительной энергии. Следовательно, если уменьшить значение показателя, то произойдёт замерзание АКБ.
Таким образом, отвечая на вопрос о том, сколько должно быть электролита в аккумуляторе, приведём следующую таблицу плотности.
| Регион | Величина плотности, г/см3 |
|---|---|
| Центральный | 1,27 |
| Южный | 1,25 |
| Северный | 1,29 |
| Крайний Север | 1,31 |
Но нужно помнить, что представленные цифры относятся лишь к АКБ с полным зарядом. Если он находится на недостаточном уровне, то значения показателя будут больше на несколько единиц.
Если он находится на недостаточном уровне, то значения показателя будут больше на несколько единиц.
Почему происходит изменение плотности электролита?
Даже многие водители со стажем не знают, почему падает плотность электролита в аккумуляторе. Это происходит в результате уменьшения заряда АКБ. Подобные перемены характерны для зимы, когда при потере значительной величины энергии значение рассматриваемого показателя становится критическим. Единственным решением этой проблемы является регулярный контроль состояния аккумулятора.
Специалисты рекомендуют время от времени отслеживать взаимосвязь между уровнем заряда и водным соотношением в составе электролита. К примеру, рассмотрим возможное развитие событий при сокращении аккумулятора на 25 % и 50 %:
- При первоначальной плотности в 1,30 г/см3 она снизится до 1,26 г/см3 и 1,22 г/см3.
- При начальном значении показателя в 1,27 г/см3 объём уменьшится до 1,23 г/см3 и 1,19 г/см3.
- При исходной величине в 1,23 г/см3 плотность упадёт до 1,19 г/см3 и 1,15 г/см3.
Таким образом, необходимо своевременно осуществлять зарядку аккумулятора, чтобы избежать падения показателя. Однако перед этим рекомендуется обратить внимание на уровень жидкости, который мог уменьшиться в процессе функционирования автомобиля. Если это произошло, требуется долить очищенную воду без содержания каких-либо добавок.
Как можно откорректировать плотность электролита в банках батареи?
Часто возникают ситуации, в которых наблюдается разная плотность электролита в банках аккумулятора. Эту проблему нужно решать незамедлительно. Как тогда выровнять плотность электролита в банках аккумулятора? Рекомендуется два варианта действий:
- Применить электролит, обладающий высокой концентрацией серы.
- Долить кислоты вспомогательного характера.
Корректировка плотности электролита в аккумуляторе осуществляется с использованием следующих предметов:
- специальная ёмкость с делениями;
- резервуар для образования новой субстанции;
- кислота, электролит;
- очищенная жидкость.

Инструкция по изменению значения показателя включает в себя следующие действия:
- Взять небольшое количество электролита с банки аккумуляторной батареи.
- Добавить корректирующий раствор в количестве, которое соответствует взятому на первом действии – если необходимо увеличить плотность электролита. Для противоположного результата регулирующий раствор замените на дистиллированную жидкость.
- Аккумулятор следует подзарядить специальным устройством, так как номинальный ток позволит поступившей воде перемешаться.
- Отключив АКБ от батареи, целесообразно выждать в районе 2 часов. Это позволит плотности во всех банках встать на один уровень, что сделает вероятность возникновения погрешностей при контрольном измерении минимальной.
- Заново измерить значение электролита. Если оно прежнее – повторить предыдущие действия сначала.
Не всегда можно изменить показатель. И тогда единственное решение – купить новый аккумулятор. Если электролит приобретает чёрный оттенок при осуществлении зарядки, то это свидетельствует о невозможности восстановления работы АКБ.
Чем грозит повышенная или пониженная плотность электролита?
Если рассматриваемый показатель выше допустимого значения, то значит, норма превышена, что отрицательно сказывается на функционировании авто. Это в большинстве случаев приводит к возникновению различных неисправностей АКБ. Следовательно, слишком высокая плотность электролита в аккумуляторе опасна для состояния автомобиля.
Если значение показателя занижено, машина может просто не завестись. В первую очередь это касается зимнего сезона, так как батарея замёрзнет при минусовых температурах.
Таким образом, необходимо осуществлять регулярную проверку плотности электролита. Это поможет избежать возникновения непредвиденных обстоятельств. Однако сделать подобное проблематично, так как плотность изменяется при разных уровнях заряда аккумулятора. Например, при её уменьшении происходит поглощение дистиллированной жидкости батареей, что приводит к увеличению концентрации показателя. В обратных ситуациях возникает процесс сульфатации, ведущий к снижению уровня плотности. Главный исход – выход из строя АКБ.
Например, при её уменьшении происходит поглощение дистиллированной жидкости батареей, что приводит к увеличению концентрации показателя. В обратных ситуациях возникает процесс сульфатации, ведущий к снижению уровня плотности. Главный исход – выход из строя АКБ.
Как проверить плотность электролита в аккумуляторе авто?
У кислотных аккумуляторов есть весомое преимущество по сравнению с более современными батареями, что обусловлено возможностью реанимировать их. Благодаря возможности обслуживать такие АКБ, можно восстановить плотность электролита и вернуть батарее ее свойства. Поэтому, обслуживая аккумулятор, плотность электролита в обязательном порядке требуется замерять, потому что от этого параметра зависит корректная работа АКБ. Не стоит избегать решения этой задачи, так как рано или поздно данная проблема даст о себе знать.
Рекомендуется обратиться в автосервис, если руки не доходят до самостоятельного обслуживания батареи. Его особенность заключается в том, что измерить плотность электролита аккумуляторе можно самостоятельно, имея под рукой ареометр и зная, каким параметрам она должна соответствовать. Параллельно с этим замером выявляется уровень электролита, затем данные сравниваются с выходным напряжением батареи. Это дает общую картину о состоянии АКБ, что необходимо для правильного выполнения восстановительных работ.
Для тех кто не знает, как измерить плотность аккумулятора, сразу оговоримся, что это необходимо делать в каждой банке со свинцовыми пластинами, так как они не зависят друг от друга. Поэтому плотность и уровень электролита, а также выходное напряжение у них будет отличаться. Рассмотрим детально, как измерить плотность электролита с учетом всех технических нюансов, которые необходимо знать.
Когда должна выполняться проверка плотности автомобильного аккумулятора
Кроме того, что плотность электролита автомобильного аккумулятора проверяется при каждом плановом обслуживании машины, существует ряд признаков, указывающих на снижение этого параметра.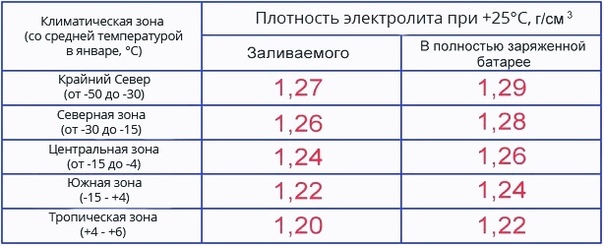
Самый распространенный заключается в уменьшении периодичности заряд/разряд. Это значит, что АКБ стал хуже держать заряд, а так происходит в результате снижения уровня электролита или его свойств. Это повод проверить плотность автомобильного аккумулятора, не дожидаясь планового техосмотра.
Также следует выполнить эту работу, если в последнее время батарея систематически перезаряжалась. Это способствует выкипанию электролита и снижению его уровня. В зимнее время эту задачу приходится выполнять чаще, так как плотность АКБ при отрицательной температуре быстрее снижается.
Как проверить плотность автомобильного аккумулятора
Если вы знаете, как проверить плотность АКБ и уже сделали это, значит вы понимаете, что нужно быть готовым к необходимости восстановления этого параметра, если он не будет соответствовать требованиям. Поэтому необходимо подготовить следующее:
ареометр;
мерный стакан;
грушу-клизму;
емкость, чтобы развести новый электролит;
кислоту или корректирующий электролит.
Посредством ареометра сначала нужно проверить плотность автомобильного аккумулятора. Это выполняется с помощью груши, изготовленной из мягкой резины, в которую вставлена трубка из стекла с ареометром внутри. Для выполнения замера необходимо набрать немного жидкости из банки, сжав грушу. Затем нужно следить, чтобы ареометр не касался стенок трубки. Вся полученная информация записывается, потому что данная задача выполняется в каждой банке, но перед этим необходимо полностью зарядить батарею. Дальнейшие действия зависят от того, повышена плотность или понижена. В последнем случае необходимо сделать следующее:
отобрать немного жидкости из банки, и в таком же объеме залить корректирующий электролит;
поставить АКБ на 30 минут заряжаться;
снять с зарядки и дать батарее остыть в течение 2 часов;
повторно замерить плотность.

Если вы знаете, как проверить плотность аккумулятора автомобиля, значит понимаете зачем это делать. С добавлением коррекционного электролита повышается плотность жидкости. Чтобы замеры ареометром были точны, необходимо смешать жидкости, что происходит во время зарядки батареи. Остывать ей нужно потому, что максимальная точность замера ареометром возможна только при холодной батарее.
Если проверка плотности электролита автомобильного аккумулятора покажет увеличение данного показателя, необходимо выполнить все также, как в вышеуказанной последовательности, но вместо коррекционного электролита добавить дистиллированную воду. За счет этого плотность снизится. Если после первого раза электролит не достигнет нужного состояния, необходимо повторить процедуру еще раз. И так до тех пор, пока не нормализуется электролит, плотность при этом должна соответствовать нужному значению.
Что значит, если плотность аккумулятора автомобиля не соответствует заводским значениям
Если замеры покажут, что плотность электролита АКБ не соответствует параметрам в банках, значит батарея уже выработала свой ресурс и пластины подвергались сульфатации. Придется заменить АКБ, потому что восстановлению он не подлежит.
Сульфатация – это необратимый процесс, который настигает каждую батарею, отработавшую свой ресурс, заявленный производителем. Если плотность электролита аккумулятора напротив, выше нормы, это тоже плохо для батареи. Скорее всего он закипел, и повышение его плотности необходимо скорректировать способом, описанным выше. Рекомендуется в будущем не допускать повторного закипания, потому что это может окончательно вывести устройство из эксплуатации.
Если проверка плотности электролита в аккумуляторе показывает, что она низкая в одной из банок, значит между электродами произошло замыкание. В такой ситуации тоже требуется замена батареи, так как содержимое банок не подлежит восстановлению.
Какой должна быть плотность аккумулятора авто
Тот кто знает, как проверить плотность электролита в АКБ, должен понимать, как зависит это значение от параметров аккумулятора.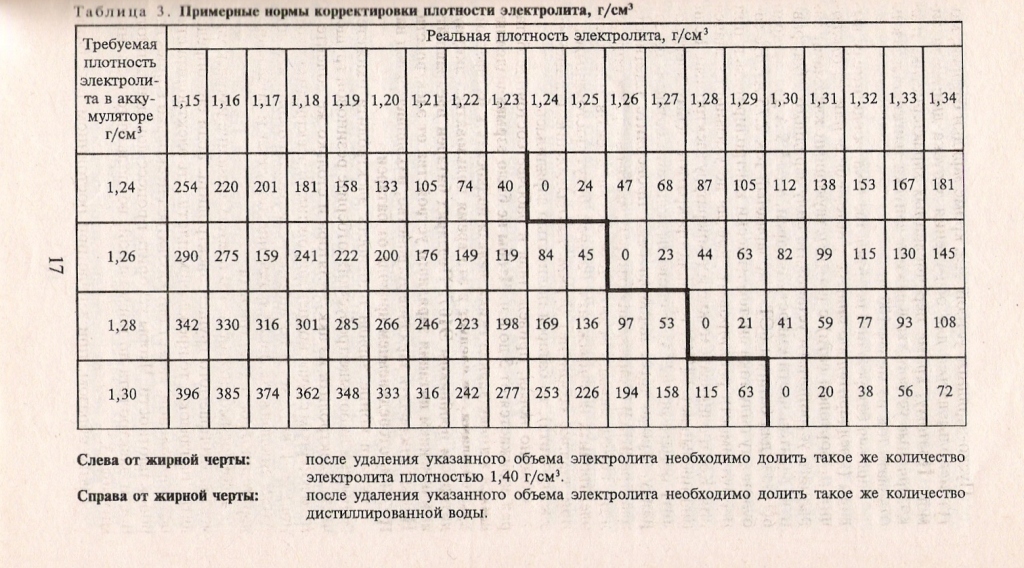 На него влияет и такие технические характеристики, как емкость батареи и сила выходного тока. Поэтому не следует ориентироваться общепринятыми стандартами, лучше изучить этикетку изделия, чтобы выяснить, какая необходима плотность. Также стоит оговориться, что проверка плотности электролита в АКБ должна определяться с учетом температуры окружающей среды. Для определения погрешности, зависящей от температуры, необходимо пользоваться специальной таблицей. Найти данную информацию можно в техническом паспорте автомобиля или руководстве производителя, прилагаемом к аккумуляторной батарее. Зная, как проверить плотность электролита в аккумуляторе, не стоит торопиться делать этого без оценки цвета жидкости.
На него влияет и такие технические характеристики, как емкость батареи и сила выходного тока. Поэтому не следует ориентироваться общепринятыми стандартами, лучше изучить этикетку изделия, чтобы выяснить, какая необходима плотность. Также стоит оговориться, что проверка плотности электролита в АКБ должна определяться с учетом температуры окружающей среды. Для определения погрешности, зависящей от температуры, необходимо пользоваться специальной таблицей. Найти данную информацию можно в техническом паспорте автомобиля или руководстве производителя, прилагаемом к аккумуляторной батарее. Зная, как проверить плотность электролита в аккумуляторе, не стоит торопиться делать этого без оценки цвета жидкости.
То, какой она имеет оттенок, поможет предварительно определить состояние батареи. Коричневый цвет предупреждает о скором выходе из строя аккумулятора, а если это происходит еще и в канун зимы, первые морозы он может и не пережить. Если оттенок темный, значит активная масса осыпалась с электродов в раствор, что затрудняет протекание электрохимических реакций. В этом случае замена батареи неизбежна, так как восстановить плотность электролита в автомобильном аккумуляторе не получится. Учитывая то, что активная масса осыпается после длительного срока эксплуатации, это вполне оправдывает затраты на покупку нового устройства.
Как говорилось выше, проверка плотности АКБ выполняется во всех банках, и в каждой из них это значение должно быть одинаковым. Допускается погрешность, но не более 1 г/см3. Критический показатель плотности аккумулятора – менее 1:18 г/см3. Но и в такой ситуации возможна реанимация, если цвет не обрел коричневый или темный оттенок. Только в данной ситуации те, кто знает, какая плотность электролита должна быть в аккумуляторе, используют не коррекционный электролит, а серную кислоту 1:18 г/см3. Чтобы работать с данным веществом, необходим опыт, так как можно добавить его слишком много, сделав плотность больше, чем требуется. В результате неумелое обращение с веществом потребует много времени на решение данной задачи.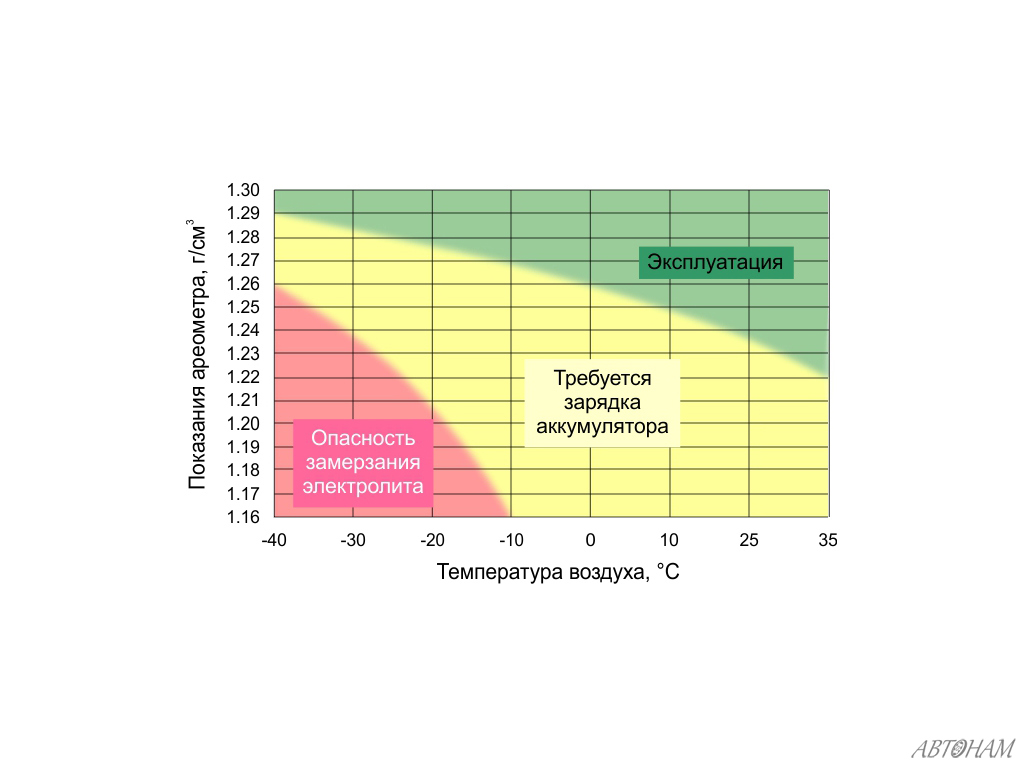 Даже тем, кто может проверить плотность аккумулятора автомобиля, понимая как ее вернуть, нелегко добиться одинаковой плотности в каждой из банок, используя кислоту. Поэтому рекомендуется обращаться в автосервисы Oiler, чтобы выполнить обслуживание аккумуляторной батареи.
Даже тем, кто может проверить плотность аккумулятора автомобиля, понимая как ее вернуть, нелегко добиться одинаковой плотности в каждой из банок, используя кислоту. Поэтому рекомендуется обращаться в автосервисы Oiler, чтобы выполнить обслуживание аккумуляторной батареи.
Чем поможет автосервис?
В условиях любого СТО нашей компании имеются все необходимые устройства и опытные специалисты, которые сумеют проверить плотность электролита и скорректировать ее в день обращения. Особенность наших услуг заключается в том, что мы решаем технические задачи в день обращения. Кроме того, услуги предлагаются по фиксированной цене, что позволяет предварительно рассчитать бюджет на обслуживание и ремонт своего автомобиля.
Мы рассмотрели, как проверить электролит в АКБ, и что делать, если его плотность отклонилась от нормы. Детально узнать о состоянии аккумуляторной батареи вы сможете, посетив автосервис Oiler в Киеве, предварительно записавшись на прием на нашем сайте.
Плотность электролита зимой и летом
Всем привет! С Вами аккумуляторщик. Сегодня я бы хотел развеять миф про плотность электролита зимой и летом. Многие люди, особенно старой «советской» закалки, которые приходят в магазин или просто приходят со своим аккумулятором и просят им сделать зимнюю или летнюю плотность. Сразу скажу, сейчас это уже не актуально.Сейчас во все аккумуляторные батареи, в частности для наших широт заливают электролит плотностью 1,27- 1,28 г/см3. И менять её не требуется, это запрещено вообще! Коррекцию электролита самостоятельно тоже нельзя делать ни в коем случае. Это может сделать только специалист по ремонту аккумуляторов, и то в крайнем случае, например, при восстановлении АКБ.
Если Вы измерите плотность на новом полностью заряженном аккумуляторе, то плотность в нем будет 1,27 ровно. Ничего подливать туда не надо! Дело в том, что многие люди думают что на зиму надо сделать поядрёнее такой покрепче электролит. На самом деле, этого не требуется. При плотности 1,27 г/см3 электролит замерзает при температуре -60 0С. Подробнее об этом Вы можете прочитать тут. В редких городах можно встретить такие экстремальные температуры воздуха, но тем не менее можно. Для таких редких случаев плотность подымают, но это скорее исключение.
При плотности 1,27 г/см3 электролит замерзает при температуре -60 0С. Подробнее об этом Вы можете прочитать тут. В редких городах можно встретить такие экстремальные температуры воздуха, но тем не менее можно. Для таких редких случаев плотность подымают, но это скорее исключение.
Слишком большая плотность делает среду чрезмерно агрессивной. И соответственно, идет быстрее осыпания пластин аккумулятора. Потому что аккумуляторная батарея на автомобиле – это сбалансированное устройство, вмешиваться в его электролит значит выводить из баланса АКБ. Как некоторые делают по старинке: доливают дистиллированную воду на лето, а зимой доливают электролит. Ничего этого делать не нужно!
Лучше позаботьтесь о другом. Например, качественно зарядите аккумулятор перед холодами хорошим зарядным устройством. Для того, чтобы плотность выровнялась по банкам АКБ и вышла у Вас к номинальной 1,27- 1,28 г/см3. С такой плотностью электролита можно ездить и летом и зимой, так скажем всесезонный аккумулятор.
Вот поэтому никогда не проводите самостоятельно манипуляций с электролитом. Только корректируем уровень дистиллированной водой. То есть, подливая воду в банки до номинального уровня. Напомню, для легковых АКБ это полтора сантиметра над свинцовыми пластинами аккумулятора, для грузовых 2-3 см. Вот и все! Ну и соответственно, заряжаем для того, чтоб достигнуть рабочей плотности.
Надеюсь наши советы по эксплуатации автомобильного аккумулятора помогут Вам в жизни. Не совершайте ошибок.
Также на эту тему:
Как измерить удельный вес
Что такое удельный вес и как его проверить?
Удельный вес используется для проверки состояния заряда аккумулятора, по сути, это отношение веса раствора к весу равного объема воды. Проверка удельного веса ячейки выполняется с помощью ареометра, лучший из которых автоматически компенсирует температуру. Поскольку соотношение воды и серной кислоты внутри батареи изменяется в зависимости от активности, изменяется и плотность электролита, это то, что измеряет ареометр. Еще один тест, который следует выполнить вместе с тестами на удельную плотность, — это проверка напряжения холостого хода вашей батареи. Trojan Battery рекомендует следующие шаги для проведения тестов на удельный вес своих аккумуляторов:
Еще один тест, который следует выполнить вместе с тестами на удельную плотность, — это проверка напряжения холостого хода вашей батареи. Trojan Battery рекомендует следующие шаги для проведения тестов на удельный вес своих аккумуляторов:
Проверка удельного веса
(используется только для залитых батарей) - Не добавляйте воду в это время.
- Перед отбором пробы наполните и слейте воду из ареометра 2–4 раза.
- В ареометре должно быть достаточно пробы электролита, чтобы полностью поддерживать поплавок.
- Снимите показания, запишите их и верните электролит обратно в ячейку.
- Чтобы проверить другую ячейку, повторите 3 шага выше.
- Проверьте все элементы в аккумуляторной батарее.
- Установите на место вентиляционные колпачки и сотрите пролившийся электролит.
- Исправьте показания до 80 ° F:
- Добавить 0,004 к показаниям на каждые 10 ° выше 80 ° F
- Вычтите 0,004 на каждые 10 ° ниже 80 ° F.
- Сравните показания.
- Проверьте уровень заряда по таблице ниже
- Проверить и записать уровни напряжения.
- Полностью зарядите аккумулятор (и).
- Снова снимите показания удельного веса.
- Проверить уровень (-а) напряжения.
- Выполните уравнительный заряд. Обратитесь к разделу «Уравновешивание батарей», чтобы узнать о правильной процедуре.
- Снова снимите показания удельного веса.
- Батарея старая, срок ее службы подходит к концу.

- Аккумулятор слишком долго оставался в разряженном состоянии.
- Электролит был потерян из-за пролива или перелива.
- Развивается слабая или плохая клетка.
- Аккумулятор перед тестированием был чрезмерно полив.
Проверка напряжения холостого хода
- Отключите все нагрузки от аккумуляторов.
- Измерьте напряжение с помощью вольтметра постоянного тока.
- Проверьте уровень заряда по Таблице 1.
- Зарядите аккумулятор, если уровень заряда составляет от 0% до 70%.
- Аккумулятор слишком долго находился в разряженном состоянии.
- Батарея неисправна.
Показания должны быть на уровне 1,277 +/- .007 или выше заводской спецификации. Если какое-либо значение удельного веса окажется низким, выполните следующие действия.
Если какие-либо значения удельного веса по-прежнему низкие, выполните следующие действия.
Если какое-либо значение удельного веса по-прежнему ниже заводской спецификации 1,277 +/- .007, то может существовать одно или несколько из следующих условий:
Для получения точных показаний напряжения батареи должны оставаться в режиме ожидания (без зарядки и разрядки) не менее 6 часов, предпочтительно 24 часа.
Если уровень заряда батареи ниже значений, указанных в таблице 1, могут существовать следующие условия:
Батареи в таких условиях следует доставить к специалисту для дальнейшей оценки или снять с эксплуатации.
ТАБЛИЦА 1.Состояние заряда в зависимости от удельного веса и напряжения холостого хода
| Процент заряда | Удельный вес с поправкой на 80 ° F | Напряжение холостого хода | |||||
| 6В | 8В | 12 В | 24 В | 36 В | 48 В | ||
| 100 | 1,277 | 6,37 | 8,49 | 12,73 | 25,46 | 38,20 | 50.93 |
| 90 | 1,258 | 6.31 | 8,41 | 12,62 | 25,24 | 37,85 | 50,47 |
| 80 | 1,238 | 6,25 | 8,33 | 12,50 | 25,00 | 37,49 | 49,99 |
| 70 | 1,217 | 6,19 | 8,25 | 12,37 | 24,74 | 37,12 | 49. 49 49 |
| 60 | 1,195 | 6,12 | 8,16 | 12,24 | 24,48 | 36,72 | 48,96 |
| 50 | 1,172 | 6,05 | 8,07 | 12,10 | 24,20 | 36,31 | 48,41 |
| 40 | 1,148 | 5,98 | 7,97 | 11,96 | 23,92 | 35,87 | 47.83 |
| 30 | 1,124 | 5,91 | 7,88 | 11,81 | 23,63 | 35,44 | 47,26 |
| 20 | 1,098 | 5,83 | 7,77 | 11,66 | 23,32 | 34,97 | 46,63 |
| 10 | 1,073 | 5,75 | 7,67 | 11,51 | 23,02 | 34,52 | 46.03 |
Как определить степень заряда аккумулятора в зависимости от плотности электролита.
Электролит, который используется для аккумуляторных батарей — смесь, состоящая из 64% воды и 36% серной кислоты.
При разряде аккумулятора при исследовании химических реакций из раствора электролита расходуется серная кислота с одновременным образованием воды и плотность электролита уменьшается, а при зарядке, наоборот, вода расходуется на образование серной кислоты и плотность электролита увеличивается.Изменение плотности электролита — эффективное средство определения уровня заряда аккумулятора. Для полностью заряженного аккумулятора плотность электролита 1,27 г / см3 обычно соответствует температуре 20 ° C.
| Плотность электролита при температуре 15 C (г / см3) | Напряжение аккумуляторной батареи без нагрузки (В) | Напряжение АКБ при нагрузке 100А подключено | Уровень заряда аккумулятора (%) | Температура замерзания электролита (С) |
|---|---|---|---|---|
| 1,27 | 12,66 | 10,80 | 100,00 | -60 |
| 1,26 | 12,60 | 10,66 | 94,00 | -55 |
| 1,25 | 12,54 | 10,50 | 87,50 | -50 |
| 1,24 | 12,48 | 10,34 | 81,00 | -46 |
| 1,23 | 12,42 | 10,20 | 75,00 | -42 |
| 1,22 | 12,36 | 10,06 | 69,00 | -37 |
| 1,21 | 12,30 | 9,90 | 62,50 | -32 |
| 1,20 | 12,24 | 9,74 | 56,00 | -27 |
| 1,19 | 12,18 | 9,60 | 50,00 | -24 |
| 1,18 | 12,12 | 9,46 | 44,00 | -18 |
| 1,17 | 12,06 | 9,30 | 37,50 | -16 |
| 1,16 | 12,00 | 9,14 | 31,00 | -14 |
| 1,15 | 11,94 | 9,00 | 25,00 | -13 |
| 1,14 | 11,88 | 8,84 | 19,00 | -11 |
| 1,13 | 11,82 | 8,68 | 12,56 | -9 |
| 1,12 | 11,76 | 8,54 | 6,00 | -8 |
| 1,11 | 11,70 | 8,40 | 0 | -7 |
Батареи (часть вторая)
Жизненный цикл батареи
Жизненный цикл батареи определяется как количество полных циклов зарядки / разрядки, которое батарея может выполнить до того, как ее нормальная зарядная емкость упадет ниже 80 процентов от первоначальной номинальной емкости. .Срок службы батареи может варьироваться от 500 до 1300 циклов. Различные факторы могут вызвать износ аккумулятора и сократить срок его службы. Первый — это чрезмерная разрядка, которая вызывает избыточное сульфатирование; во-вторых, слишком быстрая зарядка или разрядка, приводящая к перегреву пластин и отслаиванию активного материала. Накопление наплавленного материала, в свою очередь, вызывает короткое замыкание пластин и приводит к внутреннему разряду. Батарея, которая остается разряженной или разряженной в течение длительного периода времени, может быть необратимо повреждена.Ухудшение может продолжаться до точки, когда емкость элемента может упасть до 80 процентов после 1000 циклов. Во многих случаях элемент может продолжать работать почти до 2000 циклов, но с уменьшенной емкостью на 60 процентов от исходного состояния.
.Срок службы батареи может варьироваться от 500 до 1300 циклов. Различные факторы могут вызвать износ аккумулятора и сократить срок его службы. Первый — это чрезмерная разрядка, которая вызывает избыточное сульфатирование; во-вторых, слишком быстрая зарядка или разрядка, приводящая к перегреву пластин и отслаиванию активного материала. Накопление наплавленного материала, в свою очередь, вызывает короткое замыкание пластин и приводит к внутреннему разряду. Батарея, которая остается разряженной или разряженной в течение длительного периода времени, может быть необратимо повреждена.Ухудшение может продолжаться до точки, когда емкость элемента может упасть до 80 процентов после 1000 циклов. Во многих случаях элемент может продолжать работать почти до 2000 циклов, но с уменьшенной емкостью на 60 процентов от исходного состояния.
Методы испытаний свинцово-кислотных аккумуляторов
Состояние заряда аккумуляторной батареи зависит от состояния ее активных материалов, в первую очередь пластин. Однако состояние заряда батареи определяется плотностью электролита и проверяется ареометром, прибором, который измеряет удельный вес (вес по сравнению с водой) жидкостей.
Наиболее часто используемый ареометр состоит из небольшой герметичной стеклянной трубки, утяжеленной на нижнем конце так, что она плавает в вертикальном положении. [Рисунок 12-195] Внутри узкого стержня трубки находятся бумажные весы с диапазоном значений от 1,100 до 1,300.
Рисунок 12-195. Ареометр (показания удельного веса).При использовании ареометра количество электролита, достаточное для плавания ареометра, набирается в шприц. Глубина погружения ареометра в электролит определяется плотностью электролита, а значение шкалы, указанное на уровне электролита, является его удельным весом.Чем плотнее электролит, тем выше плавает ареометр; следовательно, наибольшее число на шкале (1,300) находится в нижней части шкалы ареометра.
В новой, полностью заряженной аккумуляторной батарее самолета электролит состоит примерно на 30% из кислоты и на 70% из воды (по объему) и в 1,300 раз тяжелее чистой воды. Во время разряда раствор (электролит) становится менее плотным, и его удельный вес падает ниже 1,300. Показатель удельного веса от 1,300 до 1.275 указывает на высокий уровень заряда; от 1,275 до 1,240 — средний уровень заряда; а между 1.240 и 1.200 — низкий уровень заряда. Аккумуляторы для самолетов обычно имеют небольшую емкость, но подвержены большим нагрузкам. Значения, указанные для состояния заряда, поэтому довольно высоки. Ареометры периодически проводятся на всех аккумуляторных батареях, установленных в самолетах. Аккумулятор самолета в низком уровне заряда может иметь, возможно, оставшийся заряд на 50 процентов, но, тем не менее, считается низким перед лицом высоких требований, которые вскоре его исчерпают.Считается, что аккумулятор в таком состоянии заряда нуждается в немедленной подзарядке.
Во время разряда раствор (электролит) становится менее плотным, и его удельный вес падает ниже 1,300. Показатель удельного веса от 1,300 до 1.275 указывает на высокий уровень заряда; от 1,275 до 1,240 — средний уровень заряда; а между 1.240 и 1.200 — низкий уровень заряда. Аккумуляторы для самолетов обычно имеют небольшую емкость, но подвержены большим нагрузкам. Значения, указанные для состояния заряда, поэтому довольно высоки. Ареометры периодически проводятся на всех аккумуляторных батареях, установленных в самолетах. Аккумулятор самолета в низком уровне заряда может иметь, возможно, оставшийся заряд на 50 процентов, но, тем не менее, считается низким перед лицом высоких требований, которые вскоре его исчерпают.Считается, что аккумулятор в таком состоянии заряда нуждается в немедленной подзарядке.
При проверке батареи с помощью ареометра необходимо учитывать температуру электролита. Показания удельного веса на ареометре отличаются от фактического удельного веса при изменении температуры. При температуре от 70 ° F до 90 ° F корректировка не требуется, поскольку изменение недостаточно велико, чтобы его можно было учесть. Когда температура выше 90 ° F или ниже 70 ° F, необходимо применить поправочный коэффициент.Некоторые ареометры оснащены шкалой коррекции внутри трубки. Для других ареометров необходимо обращаться к таблице, предоставленной производителем. В обоих случаях поправки следует добавлять или вычитать из показаний ареометра.
Удельный вес элемента является надежным только в том случае, если в электролит ничего не было добавлено, кроме случайных небольших количеств дистиллированной воды для восполнения потерь, потерянных в результате нормального испарения. Всегда снимайте показания ареометра перед добавлением дистиллированной воды, а не после.Это необходимо для того, чтобы вода полностью смешалась с электролитом, и чтобы избежать втягивания в шприц ареометра пробы, которая не отражает истинную концентрацию раствора.
Будьте предельно осторожны при проверке свинцово-кислотной ячейки ареометром. Обращайтесь с электролитом осторожно, поскольку серная кислота обжигает одежду и кожу. Если кислота попала на кожу, тщательно промойте это место водой, а затем нанесите бикарбонат соды.
Обращайтесь с электролитом осторожно, поскольку серная кислота обжигает одежду и кожу. Если кислота попала на кожу, тщательно промойте это место водой, а затем нанесите бикарбонат соды.
Способы зарядки свинцово-кислотных аккумуляторов
При пропускании постоянного тока через аккумулятор в направлении, противоположном направлению тока разряда, аккумуляторная батарея может быть заряжена.Из-за внутреннего сопротивления (IR) в батарее напряжение внешнего источника зарядки должно быть больше, чем напряжение холостого хода. Например, напряжение холостого хода полностью заряженной 12-элементной свинцово-кислотной батареи составляет примерно 26,4 В (12 × 2,2 В), но для ее зарядки требуется примерно 28 Вольт. Это большее напряжение необходимо для зарядки из-за падения напряжения в батарее, вызванного внутренним сопротивлением. Следовательно, зарядное напряжение свинцово-кислотной батареи должно равняться напряжению холостого хода плюс падение ИК-излучения внутри батареи (произведение зарядного тока и внутреннего сопротивления).
Батареи заряжаются методом постоянного напряжения или постоянного тока. В методе постоянного напряжения [Рис. 12-196A] мотор-генератор с постоянным регулируемым напряжением пропускает ток через батарею. В этом методе ток в начале процесса высокий, но автоматически снижается, достигая значения примерно 1 ампер, когда аккумулятор полностью заряжен. Метод постоянного напряжения требует меньше времени и контроля, чем метод постоянного тока.
Рисунок 12-196. Способы зарядки аккумулятора.В методе постоянного тока [Рисунок 12-196B] ток остается почти постоянным в течение всего процесса зарядки. Этот метод требует больше времени для полной зарядки аккумулятора и к концу процесса представляет опасность перезарядки, если не соблюдать осторожность.
В самолете аккумуляторная батарея заряжается постоянным током от системы генератора самолета. Этот метод зарядки является методом постоянного напряжения, поскольку напряжение генератора поддерживается постоянным с помощью регулятора напряжения.
Когда аккумуляторная батарея заряжается, она генерирует определенное количество водорода и кислорода. Поскольку это взрывоопасная смесь, важно принять меры для предотвращения воспламенения газовой смеси. Ослабьте вентиляционные колпачки и оставьте на месте. Не допускайте появления открытого огня, искр или других источников воспламенения поблизости. Перед отключением или подключением аккумулятора к зарядке всегда отключайте питание дистанционным выключателем. На Рис. 12-197 показано оборудование для зарядки аккумулятора.
Рисунок 12-197.Зарядное устройство.Flight Mechanic рекомендует
Замена обычных добавок в электролит для аккумуляторов производными диоксолона для литий-ионных аккумуляторов с высокой плотностью энергии
Гуденаф, Дж. Б. и Ким, Ю. Проблемы перезаряжаемых литиевых аккумуляторов. Chem. Матер. 22 , 587–603 (2010).
CAS Статья Google Scholar
Тараскон, Дж. М. и Арманд, М.Проблемы и проблемы, с которыми сталкиваются перезаряжаемые литиевые батареи. Nature 414 , 359–367 (2001).
ADS CAS PubMed Статья Google Scholar
Арико, А. С., Брюс, П., Скросати, Б., Тараскон, Дж. М. и ван Шалквейк, В. Наноструктурированные материалы для передовых устройств преобразования и хранения энергии. Нат. Матер. 4 , 366–377 (2005).
ADS PubMed Статья CAS Google Scholar
Лю К., Ли, Ф., Ма, Л. П. и Ченг, Х. М. Современные материалы для хранения энергии. Adv. Матер. 22 , E28 – E62 (2010).
CAS PubMed Статья Google Scholar
Чае, С., Чой, С. Х., Ким, Н., Сунг, Дж. И Чо, Дж. Интеграция графитовых и кремниевых анодов для коммерциализации высокоэнергетических литий-ионных аккумуляторов. Angew. Chem. Int. Эд. 58 , 2–28 (2019).
Angew. Chem. Int. Эд. 58 , 2–28 (2019).
Артикул CAS Google Scholar
Liu, W. et al. Насыщенный никелем слоистый оксид переходного металла лития для высокоэнергетических литий-ионных аккумуляторов. Angew. Chem. Int. Эд. 54 , 4440–4457 (2015).
CAS Статья Google Scholar
Мантирам, А., Найт, Дж. К., Мён, С. Т., О, С. М. и Сан, Ю. К. Катоды из слоистого оксида с высоким содержанием никеля и лития: прогресс и перспективы. Adv. Energy Mater. 6 , 1501010 (2016).
Артикул CAS Google Scholar
Касаваджула, У., Ван, С. и Эпплби, А. Дж. Вводные аноды на основе нано- и объемного кремния для литий-ионных вторичных элементов. J. Источники энергии 163 , 1003–1039 (2007).
ADS CAS Статья Google Scholar
МакДауэлл, М.Т., Ли, С. В., Никс, В. Д. и Цуй, Ю. Статья в честь 25-летия: понимание литиирования кремния и других легирующих анодов для литий-ионных аккумуляторов. Adv. Матер. 25 , 4966–4985 (2013).
CAS PubMed Статья Google Scholar
Чен, З., Шеврие, В., Кристенсен, Л. и Дан, Дж. Р. Разработка электродов из аморфного сплава для литий-ионных аккумуляторов. Electrochem. Solid State Lett. 7 , A310 – A314 (2004).
CAS Статья Google Scholar
Choi, N.-S. и другие. Влияние добавки фторэтиленкарбоната на межфазные свойства кремниевого тонкопленочного электрода. J. Источники энергии 161 , 1254–1259 (2006).
ADS CAS Статья Google Scholar
Шобукава, Х. , Альварадо, Дж., Янг, Й. и Мэн, Ю.С. Электрохимические характеристики и межфазные исследования кремниевого композитного анода для литий-ионных батарей в полной ячейке. J. Источники энергии 359 , 173–181 (2017).
, Альварадо, Дж., Янг, Й. и Мэн, Ю.С. Электрохимические характеристики и межфазные исследования кремниевого композитного анода для литий-ионных батарей в полной ячейке. J. Источники энергии 359 , 173–181 (2017).
ADS CAS Статья Google Scholar
Zhao, H. et al. Пленкообразующие добавки к электролиту для литий-ионных аккумуляторов: прогресс и перспективы. J. Mater. Chem. A 7 , 8700–8722 (2019).
CAS Статья Google Scholar
Xu, G. et al. Назначение функциональных добавок для устранения плохих характеристик высоковольтных (класс 5 В) LiNi0,5 Mn1,5 O4 / MCMB Li-ion аккумуляторов. Adv. Energy Mater. 8 , 1701398 (2018).
Артикул CAS Google Scholar
Han, J. G. et al. Несимметричный фторированный малонатоборат как амфотерная добавка для литий-ионных аккумуляторов с высокой плотностью энергии. Energy Environ. Sci. 11 , 1552–1562 (2018).
CAS Статья Google Scholar
Haregewoin, A. M., Wotango, A. S. & Hwang, B. J. Электролитные добавки для электродов литий-ионных аккумуляторов: прогресс и перспективы. Energy Environ. Sci. 9 , 1955–1988 (2016).
CAS Статья Google Scholar
Чой, Н.-С. и другие. Проблемы, с которыми сталкиваются литиевые батареи и электрические двухслойные конденсаторы. Angew. Chem. Int. Эд. 51 , 9994–10024 (2012).
CAS Статья Google Scholar
Jo, H. et al. Стабилизация межфазного слоя твердого электролита и циклические характеристики кремний-графитового анода батареи с помощью бинарной добавки фторированных карбонатов. J. Phys. Chem. C 120 , 22466–22475 (2016).
J. Phys. Chem. C 120 , 22466–22475 (2016).
CAS Статья Google Scholar
Nguyen, C.C. и Lucht, B.L. Улучшенные характеристики циклирования анодов из наночастиц Si за счет введения метиленэтиленкарбоната. Electrochem. Commun. 66 , 71–74 (2016).
CAS Статья Google Scholar
Чен, Л., Ван, К., Се, X. и Се, Дж. Влияние виниленкарбоната (ВК) в качестве добавки к электролиту на электрохимические характеристики кремниевого пленочного анода для литий-ионных аккумуляторов. J. Источники энергии 174 , 538–543 (2007).
ADS CAS Статья Google Scholar
Далави, С., Гудуру, П. и Лучт, Б. Л. Добавки к электролиту, улучшающие характеристики литий-ионных батарей с кремниевыми анодами. J. Electrochem. Soc. 159 , A642 – A646 (2012).
CAS Статья Google Scholar
Etacheri, V. et al. Влияние фторэтиленкарбоната (FEC) на характеристики и химию поверхности анодов литий-ионных аккумуляторов с Si-нанопроволокой. Langmuir 28 , 965–976 (2012).
CAS PubMed Статья Google Scholar
Xu, C. et al. Улучшенные характеристики кремниевого анода для литий-ионных аккумуляторов: понимание механизма модификации поверхности фторэтиленкарбоната как эффективной добавки к электролиту. Chem. Матер. 27 , 2591–2599 (2015).
CAS Статья Google Scholar
Jaumann, T. et al. Срок службы в зависимости от производительности: понимание роли FEC и VC в литий-ионных батареях высокой энергии с нанокремниевыми анодами. Energy Storage Mater. 6 , 26–35 (2017).
Артикул Google Scholar

Ким, К.и другие. Понимание термической нестабильности фторэтиленкарбоната в электролитах на основе LiPF6 для литий-ионных аккумуляторов. Электрохим. Acta 225 , 358–368 (2017).
CAS Статья Google Scholar
Schiele, A. et al. Критическая роль фторэтиленкарбоната в газовыделении кремниевых анодов для литий-ионных аккумуляторов. ACS Energy Lett. 2 , 2228–2233 (2017).
CAS Статья Google Scholar
Schwenke, K.U., Solchenbach, S., Demeaux, J., Lucht, B.L. и Gasteiger, H.A. Воздействие CO 2 возникло из VC и FEC во время образования графитовых анодов в литий-ионных батареях. J. Electrochem. Soc. 166 , A2035 – A2047 (2019).
CAS Статья Google Scholar
Aurbach, D. et al. Об использовании виниленкарбоната (ВК) в качестве добавки к растворам электролитов для литий-ионных аккумуляторов. Электрохим. Acta 47 , 1423–1439 (2002).
CAS Статья Google Scholar
Buqa, H. et al. Формирование пленки SEI на высококристаллических графитовых материалах в литий-ионных батареях. J. Источники энергии 153 , 385–390 (2006).
ADS CAS Статья Google Scholar
Michan, A. L. et al. Восстановление фторэтиленкарбоната и виниленкарбоната: понимание добавок к электролиту литий-ионных аккумуляторов и межфазного образования твердого электролита. Chem. Матер. 28 , 8149–8159 (2016).
CAS Статья Google Scholar
Ushirogata, K., Sodeyama, K., Okuno, Y. & Tateyama, Y. Аддитивный эффект на восстановительное разложение и связывание карбонатного растворителя с образованием межфазной фазы твердого электролита в литий-ионной батарее.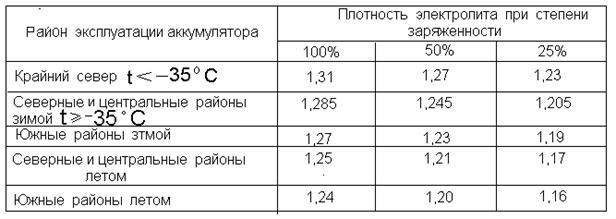 J. Am. Chem. Soc. 135 , 11967–11974 (2013).
J. Am. Chem. Soc. 135 , 11967–11974 (2013).
CAS PubMed Статья Google Scholar
Ота, Х., Саката, Ю., Иноуэ, А., Ямагути, С. Анализ слоев SEI, полученных из виниленкарбоната, на графитовом аноде. J. Electrochem. Soc. 151 , A1659 – A1669 (2004).
CAS Статья Google Scholar
Wang, Y., Nakamura, S., Tasaki, K. & Balbuena, P. B. Теоретические исследования для понимания химического состава поверхности угольных анодов для литий-ионных батарей: как виниленкарбонат играет свою роль в качестве добавки к электролиту? J. Am. Chem. Soc. 124 , 4408–4421 (2002).
CAS PubMed Статья Google Scholar
Херстедт, М., Андерссон, А.М., Ренсмо, Х., Зигбан, Х. и Эдстрем, К.Характеристика SEI, образованного на природном графите в электролитах на основе ПК. Электрохим. Acta 49 , 4939–4947 (2004).
CAS Статья Google Scholar
Zhang, S. S., Xu, K. & Jow, T. R. Исследование EIS по образованию границы раздела твердого электролита в литий-ионной батарее. Электрохим. Acta 51 , 1636–1640 (2006).
CAS Статья Google Scholar
Son, H. B. et al. Влияние восстанавливающих циклических карбонатных добавок и линейных карбонатных сорастворителей на быструю заряжаемость ячеек LiNi0.6Co0.2Mn0.2O2 / графит. J. Источники энергии 400 , 147–156 (2018).
ADS CAS Статья Google Scholar
Deng, B. et al. Влияние потенциала отсечки заряда на добавку электролита для полных ячеек с мезоуглеродными микрошариками LiNi0.6Co 0.2Mn0.2O2. Energy Technol. 7 , 1800981 (2019).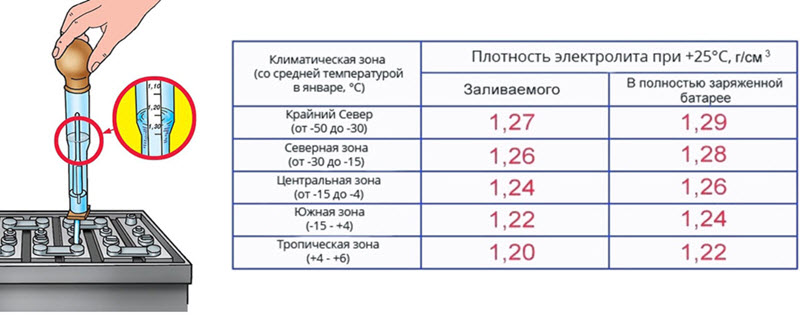
Артикул CAS Google Scholar
Zuo, X. et al. Влияние трис (триметилсилил) бората на сохранение высоковольтной емкости ячеек LiNi0,5Co0,2Mn0,3O2 / графит. J. Источники энергии 229 , 308–312 (2013).
CAS Статья Google Scholar
Deng, B. et al. Исследование влияния высоких температур на циклическую стабильность LiNi0.Катод 6Co0.2Mn0.2O2 с использованием инновационной добавки к электролиту. Электрохим. Acta 236 , 61–71 (2017).
ADS CAS Статья Google Scholar
Han, J.-G., Kim, K., Lee, Y. & Choi, N.-S. Поглощающие материалы для стабилизации LiPF6-содержащих карбонатных электролитов для литий-ионных аккумуляторов. Adv. Матер. 31 , 1804822 (2019).
Артикул CAS Google Scholar
Фенг, П., Ли, К. Н., Ли, Дж. У., Чжан, К. и Нгаи, М. Ю. Доступ к новому классу синтетических строительных блоков посредством трифторметоксилирования пиридинов и пиримидинов. Chem. Sci. 7 , 424–429 (2016).
CAS PubMed Статья Google Scholar
Alpegiani, M., Zarini, F. & Perrone, E. О получении 4-гидроксиметил-5-метил-1,3-диоксол-2-она. Synth. Commun. 22 , 1277–1282 (1992).
CAS Статья Google Scholar
Liu, J. B. et al. Серебро-опосредованное окислительное трифторметилирование фенолов: прямой синтез арилтрифторметиловых эфиров. Angew. Chem. Int. Эд. 54 , 11839–11842 (2015).
CAS Статья Google Scholar
Фарлоу М. У., Мэн Э. Х. и Таллок Д. В. Карбонилфторид.Неорганические синтезы (Rochow, E.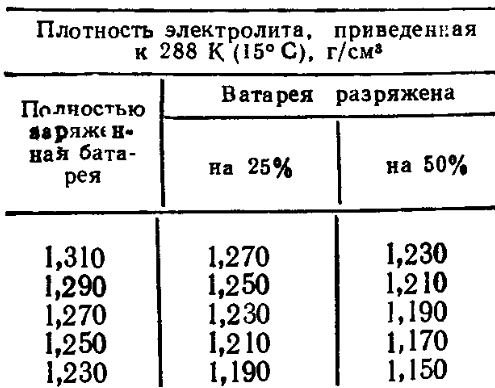 G. ed.) Vol. 6, 155–158 (McGraw-Hill Book Company, Inc., 1960). https://doi.org/10.1002/9780470132371.ch58.
G. ed.) Vol. 6, 155–158 (McGraw-Hill Book Company, Inc., 1960). https://doi.org/10.1002/9780470132371.ch58.
Аватанео М., Де Патто У., Галимберти М. и Маркионни Г. Синтез α, ω-диметоксифторполиэфиров: механизм реакции и кинетика. J. Fluor. Chem. 126 , 631–637 (2005).
Артикул Google Scholar
Петцольд, Д.и другие. Опосредованное видимым светом высвобождение и превращение фторфосгена in situ. Chem. Евро. J. 25 , 361–366 (2019).
CAS PubMed Статья Google Scholar
Xu, W., Vegunta, S. S. & Flake, J. C. Поверхностно-модифицированные кремниевые нанопроволочные аноды для литий-ионных аккумуляторов. J. Источники энергии 196 , 8583–8589 (2011).
ADS CAS Статья Google Scholar
Zhang, J. et al. Прямое наблюдение неоднородной межфазной границы твердого электролита на аноде из MnO с помощью атомно-силовой микроскопии и спектроскопии. Nano Lett. 12 , 2153–2157 (2012).
ADS CAS PubMed Статья Google Scholar
Wan, G. et al. Подавление роста дендритного лития путем образования на месте химически стабильной и механически прочной межфазной границы твердого электролита. ACS Appl. Матер. Интерфейсы 10 , 593–601 (2018).
CAS PubMed Статья Google Scholar
Снеддон И. Н. Связь между нагрузкой и проникновением в осесимметричной задаче Буссинеска для штампа произвольного профиля. Внутр. J. Eng. Sci. 3 , 47–57 (1965).
MathSciNet МАТЕМАТИКА Статья Google Scholar
Колле, Дж. П., Шуман, Х., Леджер, Р. Э., Ли, С. и Вайзель, Дж. У. Эластичность отдельного фибринового волокна в сгустке. Proc. Natl Acad. Sci. США 102 , 9133–9137 (2005).
и Вайзель, Дж. У. Эластичность отдельного фибринового волокна в сгустке. Proc. Natl Acad. Sci. США 102 , 9133–9137 (2005).
ADS CAS PubMed Статья Google Scholar
Чжан, К., Ву, Т., Лу, Дж. И Амин, К. Растворение, миграция и осаждение ионов переходных металлов в литий-ионных батареях на примере катодов на основе марганца — критический обзор . Energy Environ. Sci. 11 , 243–257 (2018).
CAS Статья Google Scholar
Гилберт, Дж. А., Шкроб, И. А. и Абрахам, Д. П. Растворение переходного металла, миграция ионов, электрокаталитическое восстановление и потеря емкости в полных литий-ионных элементах. J. Electrochem. Soc. 164 , A389 – A399 (2017).
CAS Статья Google Scholar
Ravdel, B. et al. Термостойкость электролитов литий-ионных аккумуляторов. J. Источники энергии 119-121 , 805–810 (2003).
ADS CAS Статья Google Scholar
Ko, M. et al. Масштабируемый синтез графита, внедренного в кремний в нанослой, для высокоэнергетических литий-ионных аккумуляторов. Нат. Энергетика 1 , 16113 (2016).
ADS CAS Статья Google Scholar
Делли, Б. Полностью электронный численный метод решения функционала локальной плотности для многоатомных молекул. J. Chem. Phys. 92 , 508–517 (1990).
ADS CAS Статья Google Scholar
Делли Б. От молекул к твердым телам с подходом DMol 3 . J. Chem. Phys. 113 , 7756–7764 (2000).
ADS CAS Статья Google Scholar

Klamt, A. & Schüürmann, G. COSMO: новый подход к диэлектрическому экранированию в растворителях с явными выражениями для экранирующей энергии и ее градиента. J. Chem. Soc. Perkin Trans. 2 , 799–805 (1993).
Артикул Google Scholar
Холл, Д. С., Селф, Дж. И Дан, Дж. Р. Диэлектрические постоянные для квантовой химии и литий-ионных аккумуляторов: смеси растворителей этиленкарбоната и этилметилкарбоната. J. Phys. Chem. C 119 , 22322–22330 (2015).
CAS Статья Google Scholar
Лойенга, Х. Диэлектрические проницаемости гетерогенных смесей. Physica 31 , 401–406 (1965).
ADS CAS Статья Google Scholar
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Последние достижения в области высоковольтных и высокоэнергетических водных аккумуляторных батарей
Водные аккумуляторные литиевые батареи (ARLB)
Водные аккумуляторные литиевые батареи (ARLB) разрабатываются с 1994 года [4].Они имеют среднее напряжение разряда около 1,5 В и работают обратимо. Они могут обеспечить удельную энергию 75 Вт · ч · кг −1 (исходя из общей массы активных материалов), что сопоставимо с характеристиками свинцово-кислотных и никель-кадмиевых аккумуляторов. Как указано в этой новаторской исследовательской работе, окислительно-восстановительные потенциалы выделения водорода (HER) и кислорода (OER) являются важными контрольными факторами при выборе материалов для двух электродов для ARLB. Другими словами, рабочий потенциал материала электрода должен быть между OER и HER, чтобы избежать реакции электролиза воды.В последнее время появилось много подробных обзоров электродных материалов ARLB [3, 5,6,7,8,9]. Поэтому мы не будем здесь подробно останавливаться на этом. В этой части мы только резюмируем текущую работу по ARLB высокого напряжения и плотности энергии.
Для создания ARLB высокого напряжения и высокой плотности энергии существует несколько стратегий: (1) улучшение электролита, например использование сверхконцентрированных электролитов, и (2) использование материалов отрицательных электродов (таких как сера, литий, цинк и др.). графит) с высокой удельной емкостью и / или низким окислительно-восстановительным потенциалом [10].
Сверхконцентрированные электролиты
Электролиты «вода в соли» / «вода в бисоле»
Электролит «вода в соли» (WiS) был впервые использован в ARLB в 2015 году Ван и его коллегами, что расширило окно электрохимической стабильности до прибл. 3,0 В (1,9–4,9 В по сравнению с Li + / Li) и открыли новые возможности в водной электрохимии [11]. Бис (трифторметансульфонил) имид лития (LiTFSI) был выбран в качестве соли из-за его высокой растворимости в воде (> 20 м; в этой статье единица m относится к моль кг -1 ), а также из-за его высокой концентрации с гидратированная вода, обладающая высокой гидролитической стабильностью.Определение WiS применяется, когда вес и объем соли превышают вес и объем растворителя в бинарной системе. Когда концентрация LiTFSI достигает 21 м, его окно электрохимической стабильности увеличивается до 3 В (рис. 2а). В этом отчете LiMn 2 O 4 и Mo 6 S 8 были использованы в качестве материалов отрицательного электрода для сборки ARLB, что подтвердило возможность использования 21-метрового электролита WiS. Стоит отметить, что окислительно-восстановительные потенциалы этих электродных материалов переходят в положительный потенциал с увеличением концентрации соли.Согласно уравнению Нернста, это в основном связано с изменением в нем активности Li + . Эти ARLB могут выдавать до 2,3 В и иметь среднее напряжение разряда 1,83 В, что значительно выше, чем у традиционных ARLB или ARLB 1-го поколения, использующих обычные водные растворы электролитов. Существует две причины, по которым электролит WiS имеет такой широкий диапазон напряжений (см. Рис. 2b). С одной стороны, свободных молекул воды достаточно, чтобы полностью гидратировать ионы лития в разбавленном водном растворе.С увеличением концентрации соли становится доступным меньше некоординированных молекул воды, и сольватация или гидратированный слой иона лития резко изменяется. Когда концентрация увеличивается до 21 мкм, отношение воды к иону лития составляет всего 2,6, что означает, что Li + частично обезвоживается, и электростатическое поле, создаваемое формальным зарядом на ионе лития, больше не может нейтрализоваться координацией с водой. В результате ионы TFSI — попадают в сольватационный слой Li + .Поскольку потенциал восстановления TFSI — ниже, чем у воды, TFSI — разлагается на поверхности материала отрицательного электрода с образованием плотного защитного слоя SEI (в основном LiF) перед разложением воды. С другой стороны, активность воды снижается из-за небольшого количества свободных молекул воды после высокой концентрации, что помогает повысить электрохимическую стабильность положительных и отрицательных электродов. Следовательно, можно видеть, что взаимодействие этих двух факторов значительно расширяет диапазон напряжений электролита.Однако материалы положительного и отрицательного электрода, выбранные для батареи, не полностью используют окно напряжения электролита LiTFSI WiS. Аккумулятор Mo 6 S 8 / LiFePO 4 [12] и аккумулятор TiS 2 / LiMn 2 O 4 [13] ведут себя аналогичным образом. Следовательно, необходима дальнейшая оптимизация материалов положительного и отрицательного электродов для дальнейшего повышения напряжения и плотности энергии ARLB. Для материалов положительного электрода могут быть выбраны материалы с более высоким потенциалом и / или более высокой удельной емкостью, такие как LiVPO 4 F, LiCoO 2 и LiNi 0.5 Mn 1,5 O 4 . Для отрицательных электродов также могут быть выбраны материалы с более низким потенциалом и / или более высокой удельной емкостью, такие как LiVPO 4 F, TiO 2 и сера.
Рис. 2a Окно электрохимической стабильности электролитов LiTFSI-H 2 O с различной концентрацией. b Схематическая диаграмма эволюции оболочки первичной сольватации Li + в разбавленном растворе и водно-солевом электролите.Воспроизведено с разрешения Ref. [11]. Авторские права 2015, AAAS. c Профили напряжения заряда и разряда полных элементов LiVPO 4 F при различных скоростях. d Длительная цикличность полных ячеек LiVPO 4 F при 20 C. Воспроизведено с разрешения Ref. [14]. Copyright 2017, John Wiley and Sons
LiVPO 4 F типа таворит может использоваться в качестве материалов как положительных, так и отрицательных электродов для ARLB [14]. Кривая заряда-разряда при постоянном токе (рис.2в) показывает, что LiVPO 4 F имеет два набора плато заряда и разряда, которые, соответственно, соответствуют интеркаляции и деинтеркаляции ионов лития. Группа с высоким потенциалом соответствует редокс-паре V 4+ / V 3+ (около 4,26 В по сравнению с Li + / Li), а группа с низким потенциалом соответствует V 3+ / V 2+ редокс-пара (около 1,8 В относительно Li + / Li). Используя этот материал как положительный и отрицательный электроды, соответственно, и гелевый электролит LiTFSI «вода-в-соли», гибкий симметричный аккумулятор был собран с 2.Выходное напряжение 46 В (среднее напряжение разряда до 2,4 В), демонстрируя отличные характеристики.
Характеристики симметричной ячейки с 21-метровым электролитом LiTFSI WiS неудовлетворительны, а кулоновский КПД составляет 96% всего после 50 циклов. Гелевый электролит LiTFSI WiS толщиной 25 мкм был приготовлен путем добавления ПВС, и окно стабильности напряжения было расширено. Собранная таким образом симметричная батарея подвергалась циклическому включению с низкой скоростью 0,2 ° С. Всего за десять циклов кулоновский КПД достиг 100%.При температуре 20 ° C емкость батареи все еще составляла 87% после 4000 циклов, а кулоновский КПД был близок к 100% в течение всего цикла (рис. 2d). Также впервые было обнаружено, что пленка SEI на поверхности материала положительного электрода в электролите LiTFSI WiS представляет собой смесь 49% Li 2 CO 3 и 51% LiF. Это открытие раскрыло секрет того, как Li + может транспортироваться в SEI, поскольку LiF является изолятором как для ионной, так и для электронной проводимости.Если SEI состоит в основном из LiF, очевидно, что он не будет способствовать передаче Li + . Поскольку Li 2 CO 3 имеет лучшую проводимость, чем LiF, область носителей сверхвысокой концентрации создается пространственным зарядом на границе раздела между Li 2 CO 3 и LiF, который является каналом быстрого Li + ионный транспорт. Следовательно, даже в плотной пленке SEI ионы Li + все еще могут быстро переноситься вдоль границы зерен LiF / Li 2 CO 3 , что объясняет хорошие характеристики LiVPO 4 F.Результаты испытания импеданса переменного тока показывают, что сопротивление интерфейса отрицательного электрода увеличивается только на 50% после 20 циклов, что показывает, что LiF – Li 2 CO 3 –SEI по-прежнему обеспечивает высокую проводимость для ионов Li + . .
Многослойный LiCoO 2 электродов обеспечивают удельную емкость 140 мАч г −1 при зарядке до 4,2 В (по сравнению с Li + / Li), что соответствует экстракции 50% Li до Li 0,5 CoO 2 , который считается относительно стабильным материалом положительного электрода в ARLB [15,16,17,18].В органических электролитах при зарядке до 4,5 В (по сравнению с Li + / Li) обеспечивается более высокая удельная емкость 180 мАч g -1 (соответствует экстракции 70% Li). Однако электрод страдает от серьезного снижения емкости во время циклирования в водных электролитах из-за растворения Co и побочной реакции между Li 0,3 CoO 2 и электролитом. Трис (триметилсилил) борат (TMSB) вводился в электролит WiS в качестве добавки и непрерывно окислялся и разлагался с образованием стабильной межфазной пленки катод-электролит (CEI) на поверхности положительного электрода LiCoO 2 во время процесса зарядки. .Wang et al. обнаружили, что после окисления TMSB образует защитную межфазную поверхность на положительном электроде LiCoO 2 [19]. При высоком напряжении отсечки LiCoO 2 с межфазной защитой обеспечивал высокую емкость 170 мАч g −1 с замечательной стабильностью переключения. ARLB, соединяющий положительный электрод LiCoO 2 с отрицательным электродом Mo 6 S 8 , показал напряжение холостого хода 2,50 В и напряжение средней точки 1,95 В, достигая плотности энергии до 120 Втч кг -1 и низкой скорость спада емкости 0.013% за цикл, так как защитная межфазная поверхность эффективно подавляет OER и растворение кобальта от положительного электрода в растворе электролита.
Промышленная шпинель LiNi 0,5 Mn 1,5 O 4 имеет две кристаллические структуры: P4332 и fd-3 m. Среди них P4332 LiNi 0,5 Mn 1,5 O 4 имеет более высокое плато окислительно-восстановительного потенциала лития / делитирования, а из-за высокой концентрации соли в электролите WiS, платформа окислительно-восстановительного потенциала интеркаляции / делитирования LiNi 0.5 Mn 1,5 O 4 имеет положительный сдвиг примерно от 0,2 В до 4,8–5,0 В (по сравнению с Li / Li + ), что находится за пределами окна стабильности электролита WiS. Редокс-потенциал fd-3 m LiNi 0,5 Mn 1,5 O 4 ниже, чем у P4332 LiNi 0,5 Mn 1,5 O 4 . Редокс-потенциал fd-3 m LiNi 0,5 Mn 1,5 O 4 отличается от такового у P4332 LiNi 0,5 Mn 1.5 O 4 , поскольку в fd-3 м LiNi 0,5 Mn 1,5 O 4 имеется небольшое количество Mn 3+ , а ионный радиус Mn 3+ больше этого Mn 4+ , что приводит к расширению решетки и увеличению диффузии Li + . В электролите WIS две платформы напряжения fd-3 m LiNi 0,5 Mn 1,5 O 4 перемещаются до 4,8–5,0 В. Хотя они превышают окно стабильности напряжения электролитов, они могут полностью использовать свои емкость путем регулирования значения pH электролитов, чтобы ингибировать реакцию выделения кислорода.Хорошо известно, что с понижением pH потенциал HER и OER в водных электролитах будет повышаться. Когда 0,1% (в объемных долях) 1 м бис (трифторметилсульфонил) имида (HN (SO 2 CF 3 ) 2 , HTFSI) было добавлено в электролит WiS, значение pH электролита WiS снизилось до 5, и окно сдвинулось на 0,1 В. Однако самый низкий окислительно-восстановительный потенциал (2,1 В) Mo 6 S 8 все еще выше, чем у HER (1,9 В) электролитов WiS (pH доведен до 5).Положительный материал fd-3 m LiNi 0,5 Mn 1,5 O 4 можно заряжать до 5,05 В (по сравнению с Li + / Li), и он может работать стабильно. Таким образом, Mo 6 S 8 // LiNi 0,5 Mn 1,5 O 4 полных элемента , которые имеют среднее напряжение разряда до 2,35 В и плотность энергии 126 Втч кг −1 [20].
Когда 7 м LiOTf (трифторметансульфонат лития) непрерывно добавлялся к 21 м электролитам LiTFSI WiS (обратите внимание, что первоначальный термин «растворять» не подходит, поскольку невозможно получить такой настоящий водный раствор), чтобы получить «вода в бисальте». ”(WibS) электролиты, в которых концентрация ионов Li + достигала 28 мкм, соответствующее отношение молекул воды к ионам соли составляло около 2 [21].Из-за более высокой концентрации соли плотность слоя SEI увеличивалась, а активность воды снижалась еще больше, так что он имел более широкое окно электрохимической стабильности около 3,1 В (рис. 3а). На основе этого электролита WibS был приготовлен ARLB с TiO 2 в качестве отрицательного электрода и LiMn 2 O 4 в качестве положительного электрода, с напряжением холостого хода 2,5 В, плато напряжения 2,07 В и энергией плотность 100 Вт · ч кг −1 (рассчитана исходя из суммарной массы электродов) (рис.3б). Электролит WibS на основе ацетата был сконструирован путем смешивания неорганических солей LiOAc и KOAc, которые имели отношение воды к катионам всего 1,3 [22]. Результаты показывают, что обычные материалы отрицательного электрода, такие как Li 4 Ti 5 O 12 и TiO 2 , могут обратимо интеркалировать / деинтеркалировать Li + в этом электролите WibS, и собранный TiO 2 / Mn 2 O 4 ARLB имеет плоское разрядное плато 2,10 В (рис.3в). Электролит недорогой, экологически чистый, легко регулируется, легко адаптируется и универсален.
Рис.3a Электрохимические окна электролитов WibS и WiS при скорости сканирования 10 мВ с −1 и первые следы CV активных электродов (C-TiO 2 и LiMn 2 O 4 ) при скорости сканирования 0,1 мВ с −1 в электролитах WibS. b Профили заряда-разряда C-TiO 2 / LiMn 2 O 4 аккумуляторов в 5-м и 100-м циклах.Воспроизведено с разрешения Ref. [21]. Авторское право 2016, Wiley – VCH. c Профиль заряда-разряда c-TiO 2 / LiMn 2 O 4 батареи при 0,5 C в электролитах WibS на основе ацетата. Воспроизведено с разрешения Ref. [22]. Авторское право 2018, Королевское химическое общество
Электролиты гидрат-расплав
Определение плавления гидрата аналогично определению WibS. Фактически, конструкция электролита WibS была вдохновлена электролитом гидрат-расплав [23].Электролит гидрат-расплав на самом деле является продолжением сверхконцентрированного электролита в системе, в которой вода является растворителем. Сверхконцентрированные электролиты использовались в литий-ионных батареях. Было обнаружено, что они могут не только улучшить стабильность батарей, но и увеличить рабочее напряжение (4 В). Эта концепция была впервые применена Yamada et al. к водным системам хранения энергии и известен как «гидрат-расплав». Исследовали эвтектический состав литиевых солей Li (SO 2 CF 3 ) 2 (LiTFSI) и литиевых солей Li (SO 2 C 2 F 5 ) 2 (LiBETI), оба имеют органический имидный анион.Результаты показывают, что, когда состав представляет собой Li (TFSI) 0,7 (BETI) 0,3 , растворимость смеси с водой является максимальной, может быть получен стабильный прозрачный раствор, а концентрация молекулы воды составляет всего 10,1 м ( Рис. 4а). Большое количество анионов TFSI / BETI изолируют свободные молекулы воды друг от друга, и все молекулы воды могут участвовать в гидратной оболочке ионов лития, тем самым снижая активность молекул воды и расширяя окно электрохимической стабильности электролитов.В этом растворе все молекулы воды скоординированы с ионами лития, а внутримолекулярные водородные связи практически незначительны (рис. 4б). Кроме того, было обнаружено, что равновесный потенциал реакции внедрения / отслаивания иона лития составлял 0,25 В в электролите гидрат-расплав, что было больше, чем значение в 22-метровом LiTFSI (рис. 4с). Термодинамический механизм (который снижает уровни ВЗМО) и кинетический механизм (пассивация, вызванная анионами) еще больше увеличивают разность потенциалов между анодом и катодом, тем самым расширяя окно напряжения до 3.8 В (рис. 4г). На основе электролита гидрат-расплав, Li 4 Ti 5 O 12 // LiCoO 2 и Li 4 Ti 5 O 12 // LiNi 0,5 Mn 1,5 O Было установлено 4 полных ARLB, которые демонстрировали плато высокого напряжения разрядной ячейки при 2,26 В и 3,10 В, соответственно. На данный момент существует немного других исследований по применению электролитов расплава гидрата в водных батареях. Недавно Wu et al. применили электролиты к батареям Li-O 2 , которые, как было показано, эффективно предотвращают разложение растворителя и образование побочных продуктов, тем самым увеличивая срок службы Li-O 2 батарей [24].Для дальнейшей оценки и улучшения применимости электролита необходимы все более и более глубокие исследования.
Рис. 4a Линия ликвидуса смесей LiTFSI + LiBETI в воде. b Первопринципный DFTMD моделирует снимок равновесной траектории Li (TFSI) 0,7 (BETI) 0,3 · 2H 2 O гидратный расплав и разбавленный LiTFSI / H 2 O. c Взаимосвязь между изменение равновесного потенциала интеркаляции лития и Li + -концентрации электролитов. d Окна напряжений обычных электролитов LiTFSI / H 2 O и гидратированных электролитов расплава, а также окислительно-восстановительный потенциал Li 4 Ti 5 O 12 , LiCoO 2 , LiNi 0,5 Mn 1.5 O 4 в гидратированных электролитах расплава. Воспроизведено с разрешения Ref. [23]. Copyright 2016, Nature Publishing Group
Гибридный водный / неводный электролит (HANE)
Путем введения неводного растворителя, диметилкарбоната (DMC), в электролит WiS, гибридный водно-неводный электролит (HANE) с расширенным электрохимическим окном 4.1 В. Это нейтральный растворитель, который менее чувствителен к отталкиванию отрицательного электрода и, следовательно, легче участвует в межпространственной химии, чем анионы [25]. На основе этого гибридного электролита был создан ARLB, состоящий из LiNi 0,5 Mn 1,5 O 4 положительного электрода и отрицательного электрода Li 4 Ti 5 O 12 . Этот ARLB с плоским плато разряда при 3,2 В (рис. 5а) имел плотность энергии до 165 Вт · ч · кг −1 и стабильность при циклическом изменении более 1000 циклов (рис.5б). В аналогичном подходе также сообщалось о гибридной системе «ацетонитрил (AN) / вода-в-соли» электролита (AN – WiS), обеспечивающей повышенную ионную проводимость, пониженную вязкость и расширенный диапазон температур [26]. Увеличение концентрации соли LiTFSI в AN – WiS до уровня сверхконцентрации (15,3 м) расширяет окно электрохимической стабильности до 4,5 В [27]. Эти ARLB с поддержкой AN – WiSE, такие как Li 4 Ti 5 O 12 / LiMn 2 O 4 и Li 4 Ti 5 O 12 / LiNi 0.8 Co 0,15 Al 0,05 O 2 полностью заряженных аккумулятора, с высоким напряжением, высокой плотностью энергии и отличными характеристиками при езде на велосипеде.
Рис. 5a Кривые разряда ячейки LTO-LNMO при различных скоростях. b Циклические характеристики полных ячеек LTO-LNMO при 6 C. Воспроизведено с разрешения Ref. [25]. Copyright 2018, Elsevier B.V. c Сравнение напряжения завершения зарядки различных солей для ARLB. d Кривые заряда-разряда TiO 2 / LiMn 2 O 4 элемент при 5 C; вставленный график — это циклическая производительность батареи [28].Воспроизведено с разрешения Ref. [28]. Авторские права 2018, Nature Publishing Group
Электролит «вода в иономере»
Новый тип электролитов «вода в иономере» был представлен He et al. [28]. Электролит «вода в иономере», содержащий 50 мас.% Иономера, имеет окно электрохимической стабильности 2,7 В (рис. 5c). Полный элемент LiTi 2 (PO 4 ) 3 / LiMn 2 O 4 , основанный на этом электролите, показал отличные циклические характеристики и обеспечил среднее напряжение разряда> 1.5 В и удельной энергией 77 Втч кг −1 . Кроме того, с использованием алюминиевого токосъемника была получена полная батарея TiO 2 / LiMn 2 O 4 со средним выходным напряжением 2,1 В и начальной удельной энергией 124,2 Втч кг -1 (рис. 5d) .
Роль SEI
Разложение добавок к электролиту
Добавление добавок к электролиту также может формировать на месте защитную, подобную SEI фазу интерфейса. Добавки должны соответствовать следующим требованиям: (1) иметь химическую стабильность, то есть стабильность в данном растворе электролита, и (2) иметь электрохимическую стабильность, чтобы электрохимический процесс мог происходить во время разложения с образованием межфазных компонентов.
Гель LiTFSI-HFE (высокофторированный эфир) был нанесен на поверхности отрицательных электродов в качестве межфазного покрытия-предшественника, которое было использовано для получения твердой межфазной границы, состоящей как из органических фторированных углеводородов, так и неорганических фторидов, что позволило получить высокую емкость / низкую производительность. потенциальные материалы отрицательных электродов (такие как кремний, графит и металлический Li) для обратимого цикла в гелевых полимерных электролитах (GPE) 21 м LiTFSI + 7 м LiOTf WibS (рис. 6a) [29]. Соединение отрицательных электродов с покрытием с различными материалами положительных электродов, серия из 4 штук.Были получены ARLB 0 В с высокой эффективностью и обратимостью, сопоставимые с коммерческими литий-ионными батареями (рис. 6b – d). Кроме того, был разработан ARLB со сверхвысокой плотностью энергии 460 Вт · ч кг -1 путем соединения отрицательного электрода из гелевого графита HFE и положительного электрода типа преобразования-интеркаляции (LiBr 0,5 Cl 0,5 ) -графит (LBC –G) (рис. 6д, е) [30].
Рис. 6a Зарядно-разрядные кривые графитовых электродов, предварительно покрытых гелем LiTFSI-HFE.Профили напряжения b Li / LiVPO 4 F аккумуляторов, c графитовых / LiVPO 4 F аккумуляторов и d Li / LiMn 2 O 4 аккумуляторов при 0,3 C. e Типичные кривые заряда-разряда (третьи циклы) аккумуляторов графит // LiBr / LiCl (синий) или графитовых // аккумуляторов с моногидратами LiBr / LiCl (красный). f Устойчивость этих полностью заряженных аккумуляторов во время езды на велосипеде. Воспроизведено с разрешения Ref. [29]. Авторские права 2017, Elsevier B.V. г Схематическое изображение металлического лития LISICON с пленочным покрытием. ч Кривая постоянного тока заряда-разряда Li / LiMn 2 O 4 аккумуляторов в первом цикле. Воспроизведено с разрешения Ref. [31]. Авторское право 2013, Исследования природы. i Кривые постоянного тока заряда-разряда во втором и десятом циклах Li / LiCoO 2 аккумулятора. Воспроизведено с разрешения Ref. [32]. Авторское право 2013 г., Королевское химическое общество
Искусственный SEI
Для реализации функционального металлического литиевого электрода в водной электролитной системе на его поверхность можно нанести тонкий и компактный защитный интерфейсный слой или искусственный SEI.Этот искусственный SEI должен не только иметь высокую ионную проводимость, чтобы можно было проводить электрохимический процесс, но и предотвращать проникновение воды, чтобы молекулы воды не могли проходить сквозь него, чтобы избежать реакции между молекулами воды и металлическим литием.
Наша группа представила пленку литиевого суперионного проводника (LISICON) на отрицательном электроде из металлического лития (рис. 6g) [31]. В этом исследовании LISICON служил комбинированным сепаратором и твердым электролитом с ионной проводимостью при комнатной температуре около 0.1 мСм см −1 . С LiMn 2 O 4 в качестве положительного электрода и 0,5 M Li 2 SO 4 (единица M — традиционная молярная концентрация, которая составляет моль л -1 ) в качестве электролитов, ионы лития переносятся через водный электролит со стороны положительного электрода, проходят через слой покрытия LISICON и достигают отрицательного электрода из металлического лития. Благодаря низкому потенциалу зачистки / покрытия металлического лития рабочее напряжение полученных ARLB увеличилось до более чем 4 В с плато на уровне 4.06 В и 3,85 В (рис. 6h). Подобные высоковольтные ARLB с высокой плотностью энергии были также разработаны на основе гелевой полимерной мембраны с литиево-графитовым отрицательным электродом с покрытием LISICON и положительным электродом LiCoO 2 / LiFePO 4 [32, 33]. Однако неудовлетворительная ионная проводимость LISICON может стать проблемой для достижения хороших скоростных характеристик. Ионная проводимость электрода со структурой перовскита, Al-замещенного литий-лантана-титанита (A-LLTO), разработанного Ле и соавторами, была увеличена до 0.317 мСм см −2 , что намного превышает 0,1 мСм см −2 , полученное с помощью LISICON [34]. Когда A-LLTO был применен в качестве искусственного SEI к отрицательному электроду из металлического лития, и он был объединен с положительным электродом LiCoO 2 , полученный ARLB имел напряжение холостого хода около 4,2 В и высокую удельную емкость 164 мА · ч. −1 при 0,1 C (рис. 6i). Тем не менее, его скоростные характеристики все еще не были сопоставимы с характеристиками обычных ARLB, и проблема низкой ионной проводимости искусственного SEI все еще требует решения.Более того, для создания искусственного SEI на поверхности металлического лития обычно требуется дополнительный слой для предотвращения прямого контакта между металлическим литием и проводящим разделительным слоем (LISICON, A-LLTO, LATP и т. Д.), Поскольку в противном случае последний был бы восстановлены металлическим литием из-за их химической нестабильности. Дополнительный слой обычно представляет собой гелевый полимерный электролит, состоящий из такого тонкого полимерного слоя (PVDF / PMMA / PVDF и PEO и т. Д.), Насыщенного органическими электролитами (1 M LiClO 4 в EC / DMC).
Система перезаряжаемых Ni – Li батарей была изготовлена с использованием 1 M LiClO 4 в этиленкарбонате / диметилкарбонате (EC / DMC) в качестве органических электролитов для металлического литиевого отрицательного электрода и 1 M LiOH + 1 M KOH в качестве водных электролитов. для положительного электрода Ni (OH) 2 [35]. Органический и водный электролиты были разделены тонкой пленкой LISICON. Батарея имела напряжение плато 3,47 В и удельную емкость 268 мА · ч · г -1 , что приводило к очень высокой плотности энергии 935 Вт · ч · кг -1 , исходя из общей массы активных материалов.В этой батарее использовались положительный электрод NiO / CNT конверсионного типа и отрицательный металлический литиевый электрод с гибридным водно-органическим электролитом, разделенные литий-ионной проводящей пленкой LATP (Li 1+ x + y Al x Ti 2- x Si y P 3- y O 12 ) [36]. У него было стабильное плато разряда при 3,38 В, но необходимы дальнейшие разработки, чтобы повысить его устойчивость к циклическим нагрузкам.
Использование отрицательных материалов с высокой удельной емкостью или низким окислительно-восстановительным потенциалом
Водная перезаряжаемая гибридная батарея (ARHB) с использованием положительного электрода LiMn 2 O 4 положительного электрода и металлического отрицательного электрода из цинка была впервые предложена в 2012 году и работает примерно при 2 В с приемлемой плотностью энергии (50–80 Вт · ч, –1 ) и хорошими характеристиками при циклических нагрузках (сохранение емкости 95% после 4000 циклов) [37]. Однако его электрохимические свойства, такие как кулоновский КПД, нуждаются в дальнейшем улучшении.К настоящему времени предприняты следующие меры: (1) модификация поверхности и защита материалов положительных электродов; (2) улучшение электролитов; и (3) обработка цинкового отрицательного электрода.
Из-за низкой проводимости LiMn 2 O 4 и структурных изменений, вызванных искажением Яна – Теллера, гибридная батарея Zn / LiMn 2 O 4 имеет низкие энергетические характеристики и подвергается серьезной деградации емкости. Поскольку углерод обычно может использоваться для изготовления композитов, было обнаружено, что использование графеновых пленок в качестве искусственных SEI на поверхности LiMn 2 O 4 эффективно подавляет структурные искажения LiMn 2 O 4 . и значительно увеличивает ионную проводимость LiMn 2 O 4 , таким образом улучшая цикличность и быстродействие гибридной батареи [38, 39].
Из-за ограничения окна электрохимической стабильности, образования дендритов цинка и коррозии отрицательного цинкового электрода модификация электролита является еще одним эффективным способом улучшения электрохимических характеристик водного раствора Zn / LiMn 2 O 4 гибридных аккумулятора. Многие добавки, включая тиомочевину (TU) [40], SiO 2 [41], циклодекстрин (CD) [42] и коллоидальный диоксид кремния (FS) [43], были введены в электролит для улучшения электрохимических характеристик гибридных батареи.Хотя есть некоторые улучшения, эффекты все еще неудовлетворительны, и требуется дальнейшее улучшение.
Недавно Ван и его коллеги сообщили об электролите WiS, состоящем из 1 мкм Zn (TFSI) 2 + 20 мкм LiTFSI, в котором цинковый отрицательный электрод является очень обратимым. Гибридная батарея Zn / LiMn 2 O 4 достигла наивысшей плотности энергии, когда массовое отношение Zn / LiMn 2 O 4 было уменьшено до 0,25: 1. Кроме того, кривые заряда / разряда для разных циклов гибридной батареи сильно совпадают, что показывает ее хорошую электрохимическую обратимость.При температуре 4 ° C сохранение емкости после 4000 циклов составило 85%, при этом CE достигает 99,9%, что лучше, чем все ранее описанные работы с Zn-Li-батареями [44]. Однако высокая стоимость использования больших количеств органической соли может препятствовать применению смешанных ионно-цинковых аккумуляторов в крупномасштабных системах хранения энергии.
Сообщалось о новом электролите «глубокого эвтектического растворителя (WiDES)», который может ингибировать реакцию отрицательного цинкового электрода, уменьшать коррозию и пассивацию цинкового отрицательного электрода, увеличивать коэффициент использования цинка, и улучшить жизненный цикл [45].Следовательно, гибридная батарея Zn / LiMn 2 O 4 , в которой используется этот электролит WiDES, демонстрирует отличные характеристики при циклической работе.
В дополнение к LiMn 2 O 4 , другие коммерческие материалы положительных электродов для литий-ионных батарей, такие как LiFePO 4 , LiNi 1/3 Co 1/3 Mn 1/3 O 2 , Li 3 V 2 (PO 4 ) 3 (LVP) и LiMn 0,8 Fe 0,2 PO 4 , также были изучены в качестве материалов потенциальных положительных электродов для водных аккумуляторов. Zn – Li гибридные батареи.Поскольку в нескольких статьях рассматривалась соответствующая работа в этой области, мы не будем здесь вдаваться в подробности. Эти работы сведены в Таблицу 1 и Рис. 7а.
Таблица 1 Электрохимические свойства различных ARLB с высоким напряжением и плотностью энергии Рис.7Плотность энергии и средняя разрядная емкость различных a ARLB, b ASIB, AKIBS и ANIB с высоким напряжением и плотностью энергии
Водные Na-ионные аккумуляторы
Развитие водных натрий-ионных аккумуляторов (ASIB) в основном связано с тем, что ресурсы натрия в земной коре намного больше, чем ресурсы лития.Кроме того, существует множество материалов для положительных и отрицательных электродов для ASIB, которые показывают очень хорошие электрохимические характеристики [49,50,51,52]. О ходе исследований электродных материалов написано много обзоров, и они также являются исчерпывающими [3, 6, 9]. Однако нет никаких систематических исследований того, как построить ASIB с высокой плотностью энергии. В таблице 2 и на рис. 7b представлены подробные сведения о характеристиках ASIB, о которых сообщалось на сегодняшний день.
Таблица 2 Электрохимические свойства различных ASIB, AKIBS и ANIB с высоким напряжением и плотностью энергииКак упоминалось выше, есть два способа улучшить энергетическую плотность химического состава водных аккумуляторов.Один заключается в расширении диапазона напряжений, а другой — в выборе подходящих материалов для отрицательного и положительного электродов с большой разностью потенциалов и высокой удельной емкостью.
Сверхконцентрированные электролиты
Разработка соответствующих натриевых электролитов WiS остается серьезной проблемой для разработки натрий-ионных батарей в водных растворах, поскольку существующие натриевые электролиты еще не отвечают требованиям высокой растворимости солей, содержащих химические источники (фтор). -содержащие соли), высокая химическая и электрохимическая стабильность в воде.Подобно ARLB, электролиты WiS также можно наносить на ASIB для расширения электрохимического окна. Установлено, что сила между Na + и TFSI — намного сильнее, чем сила между Li + и TFSI — , поэтому, хотя водный раствор соли NaTFSI может достигать только 9,26 м, он может образовывать SEI проводимости Na + , а окно электрохимической стабильности может достигать 2,5 В [53]. На основе этого электролита NaTi 2 (PO 4 ) 3 // Na 0.66 [Mn 0,66 Ti 0,34 ] O 2 Была собрана полная батарея со стабильной циклической производительностью и удельной энергией 31 Втч кг -1 . При комнатной температуре концентрации растворов трифторида натрия (NaOTf) и бис (трифторметансульфонил) имида (NaTFSI) низкие (9–10 м), и нельзя полностью использовать преимущество суперконцентрированных электролитов. Следовательно, для дальнейшей разработки высоковольтных ASIB необходимы соответствующие натриевые соли для производства высококонцентрированных электролитов WiS.Установлено, что NaFSI имеет высокую растворимость (до 37 моль) в водном растворе и стабильное электрохимическое окно 2,6 В при концентрации до 35 моль. Дальнейшие исследования показывают, что катоды NaTi 2 (PO 4 ) 3 и катоды Na 3 (VOPO 4 ) 2 F могут использоваться в ASIB с напряжением более 2 В [54] . Смешанные катионные смеси динатрия могут использоваться для приготовления электролитов с более высокими концентрациями, например, 9 м NaOTf + 8 м KOTf и 22 м KOTf + 4 м NaOTf.Однако присутствие нескольких катионов может привести к встраиванию смешанных катионов в материал электрода, влияя на характеристики элемента. Чтобы решить эту проблему, исследователи разработали новый класс электролитов WiS с поддержкой взаимодействия, содержащих соли трифторида тетраэтиламмония (TEAOTf), которые из-за большого ионного радиуса TEA + трудно внедрить в большинство электродных материалов [включая прусские Синий аналог (PBA)], что позволяет избежать совместной интеркаляции мультикатионов в циклическом процессе [55].Этот активированный взаимодействием электролит WiS имеет концентрацию до 31 м (9 м NaOTf – 22 м TEAOTf) и окно электрохимической стабилизации до 3,3 В (рис. 8a). A Na 1,88 Mn [Fe (CN) 6 ] 0,97 · 1,35H 2 O // IC-WiS на основе Na // NaTiOPO 4 полная батарея с высоким напряжением отсечки (2,5 В) и Была установлена высокая плотность энергии 71 Втч кг -1 , которая показала выдающуюся стабильность при циклическом изменении как на низких, так и на высоких скоростях (рис. 8b – e).
Фиг.8a Окно электрохимической стабильности 9 моль кг −1 Электролиты NaOTf и электролиты Na IC-WiS (9 м NaOTf + 22 м TEAOTf) при скорости сканирования 10 мВ с −1 , в которой Ti и Al используются как положительный и отрицательный коллекторы соответственно. b Кривые заряда-разряда первого цикла для положительных электродов NaMnHCF (1 C) и отрицательных электродов NaTiOPO 4 (0,2 C) в электролитах 9 m NaOTf и 9 m NaOTf + 22 mTEAOTf, соответственно. c Кривые CV для отрицательных электродов NaTiOPO 4 и положительных электродов NaMnHCF при 1 мВ с -1 в 22 м TEAOTf и 9 м NaOTf + 22 м TEAOTf, соответственно. d Зарядно-разрядные кривые NaMnHCF // NaTiOPO 4 аккумуляторы в первом, четвертом и десятом циклах. e Циклические характеристики батареи NaMnHCF // NaTiOPO 4 при 1 ° C [55]. Воспроизведено с разрешения Ref. [55]. Copyright 2019, Wiley – VCH
Теоретические расчеты показали, что нанесение пленки Al 2 O 3 на Al или пленки TiO 2 на Ti может увеличить энергетический барьер расщепления воды (рис.9а) [56]. При толщине около 3 нм и 5 нм соответственно для пленок Al 2 O 3 и TiO 2 окно электрохимической стабильности расширяется до 3,5 В, когда металлы, покрытые этими оксидными пленками, используются в качестве коллекторы и 15 м водный раствор NaClO 4 используется в качестве электролита (рис. 13б). Кроме того, в концентрированных электролитах (15 м NaClO 4 ) на поверхностях TiS 2 образуется плотная межфазная фаза электрод – электролит.Таким образом, TiS 2 , который имеет низкий реакционный потенциал, был впервые продемонстрирован в качестве материала отрицательного электрода в водной батарее (рис. 9c). Полученный в результате ASIB с использованием TiS 2 в качестве отрицательного электрода и MFCN (гексацианоферрат марганца натрия) в качестве положительного электрода обеспечивает плотность энергии 100 Втч кг -1 с напряжением холостого хода (OCV) до 2,6 В и было работал с почти 100% кулоновской эффективностью до 1000 циклов (рис. 9d).
Фиг.9a Окно электрохимической стабильности 15 м NaClO 4 водный раствор, когда используются Pt, Ti, Al с покрытием из Al 2 O 3 с разной толщиной и Ti с покрытием TiO 2 с разной толщиной как токоприемники. b Энергия адсорбции O * и HO * на поверхности Ti или TiO 2 и H 2 O * и H * на поверхности Al или Al 2 O 3 соответственно. c CV-кривая TiS 2 отрицательных электродов при использовании алюминиевой фольги с регулируемым временем термообработки в качестве токоприемников. d Циклические характеристики батарей TiS 2 / MFCN при 5 ° C [56]. Воспроизведено с разрешения Ref. [56]. Copyright 2019, Elsevier BV
Гибридные батареи Zn – Na
Поскольку натриевые соли дешевле, чем соли лития, гибридные ионные аккумуляторы Zn – Na на водной основе представляют собой очень многообещающую перспективу для замены гибридных аккумуляторов Zn – Li на водной основе и стали привлекательными. устойчивое устройство хранения энергии. Первый водный гибридный ионный аккумулятор Zn – Na был зарегистрирован нашей группой и состоял из стержнеобразного Na 0.95 MnO 2 материал положительного электрода и металлический отрицательный электрод из цинка, которые показали среднее напряжение разряда 1,4 В и плотность энергии до 78 Втч кг -1 (рис. 10a, b) [57].
Рис.10a CV-кривые Zn и Na 0,95 MnO 2 в 0,5 M Zn (CH 3 COO) 2 + 0,5 M CH 3 Водный раствор COONa (0,5 мВ с −1 ). b Циклические характеристики Zn // Na 0.95 MnO 2 ASIB при скорости 4 ° C [56]. Воспроизведено с разрешения Ref. [57]. Авторское право 2014 г., Королевское химическое общество. c CV-кривая Na 2 MnFe (CN) 6 положительных электродов в электролитах с добавлением SDS (5 мВ с -1 ). d Кривые заряда / разряда Na 2 MnFe (CN) 6 положительные электроды в электролитах с добавлением SDS (0,5 C) [59]. Воспроизведено с разрешения Ref. [59]. Copyright 2017, Королевское химическое общество
Na + -ионный суперионный проводник (NASICON) -структурированный Na 3 V 2 (PO 4 ) 3 (NVP) с высокой теоретической емкостью 118 мАч g -1 стал новым потенциальным кандидатом в качестве положительного электрода для водных Na-Zn-гибридных батарей.Гибридная батарея Zn-NVP может обеспечивать удельную энергию 67 Вт · ч · кг -1 . Однако емкость Na 3 V 2 (PO 4 ) 3 в гибридных водных перезаряжаемых батареях Zn – Na остается серьезной проблемой. Помимо материалов положительного электрода NVP / C, другие полианионные соединения [такие как покрытый углеродом Na 3 V 2 (PO 4 ) 2 F 3 ] рассматривались как положительные электроды для дальнейшего улучшения напряжение водных гибридных аккумуляторов Na – Zn [58].Гибридный Zn – Na 3 V 2 O 2 x (PO 4 ) 2 F 3−2 x Аккумулятор обладает высоким выходным напряжением 1,7 В и высокой энергией плотность 84 Втч кг −1 .
берлинская лазурь и ее аналоги являются наиболее привлекательными материалами для гибридных батарей на водной основе из-за их большого канала и открытой каркасной структуры, которая способствует быстрой диффузии ионов. Рабочее напряжение гибридных аккумуляторов Na-Zn на водной основе высокое, и на срок службы аккумулятора в значительной степени влияет побочная реакция выделения водорода или выделения кислорода.Было обнаружено, что окно электрохимической стабильности электролита может быть увеличено с 1,8 до 2,55 В путем добавления поверхностно-активных веществ в смешанный электролит (рис. 10а, б) [59]. С помощью моделирования теории функционала плотности было обнаружено, что энергетический барьер молекул воды, проходящих через адсорбционный слой SDS, выше, чем барьер ионов натрия, проходящих через адсорбционный слой SDS. Ионы натрия легче проходят через гидрофобный слой, чем молекулы воды, тем самым подавляя разложение воды, тем самым улучшая окно электрохимической стабильности электролита.На основе этого электролита была успешно собрана перезаряжаемая смешанная ионно-цинковая батарея на водной основе с нанокубами Na 2 MnFe (CN) 6 в качестве катодов и листами цинка в качестве отрицательных электродов. Аккумулятор имеет рабочее напряжение до 2 В и высокую удельную энергию 170 Втч кг -1 (рис. 10c, d). Стратегия проектирования улучшения окна электрохимической стабильности электролитов за счет добавления добавок обеспечивает эффективность, близкую к эффективности электролитов WiS, и низкую стоимость.Он обеспечивает новое понимание для дальнейшего развития недорогих и высоковольтных аккумуляторных батарей на водной основе.
Водные K-ионные батареи (AKIB)
Высокий потенциал ионизации и большой ионный радиус (0,138 нм) K являются основными причинами ограниченного развития высокоэффективных электродных материалов AKIB. На сегодняшний день наиболее перспективными материалами положительных электродов для AKIB являются аналоги берлинской голубой (PBA).
Среди различных материалов положительных электродов PBA имеет широкие перспективы применения благодаря своей стабильности в воде, простоте приготовления и отличным электрохимическим характеристикам.Сообщается о разнообразных положительных электродах из ПБА в AKIB, но лишь немногие материалы обладают полностью удовлетворительными свойствами. Из-за отсутствия материалов-кандидатов с подходящими окислительно-восстановительными потенциалами, несколько многообещающих материалов были описаны в качестве материала отрицательного электрода AKIB. Ранее сообщалось, что электролит WiS на основе ацетата калия имеет широкий диапазон электрохимической стабильности, но pH электролита является слабощелочным (pH = 9), что не подходит для материалов положительных электродов.Поэтому очень важно изучить новый тип электродов с лучшей совместимостью с электролитом WiS на основе K + . В целом, из-за ограничений электродов и электролитов сообщений о разнообразии AKIB немного. Недавно был изготовлен полный AKIB, и он состоял из Fe-замещенного Mn-богатого PBA {K x Fe y Mn 1- y [Fe (CN) 6 ] w · z H 2 O} положительный электрод, отрицательный электрод из органического 3,4,9,10-перилентетракарбоновой диимида (PTCDI) и 22 м KCF 3 SO 3 WiS электролит [60].22-метровый электролит KCF 3 SO 3 WiS имеет широкий диапазон напряжений 3 В, который не только препятствует растворению как положительных, так и отрицательных электродов во время цикла, обеспечивая хорошую циклическую стабильность всей батареи, но также позволяет полная батарея должна работать при напряжении выше 2 В при низком токе 0,1 C (рис. 11a). Кроме того, как положительный, так и отрицательный электроды обладают высокой емкостью, высокими скоростными характеристиками и хорошей стабильностью при переключении. Таким образом, полная батарея обеспечивает высокую удельную энергию 80 Вт · ч кг −1 и отличную стабильность при циклической работе с сохранением емкости 73% за 2000 циклов при 4 ° C (рис.11б). Несмотря на то, что эта аккумуляторная система имеет много преимуществ, есть еще много областей, требующих дальнейшего улучшения для содействия ее практическому применению. Прежде всего, для электродных материалов, хотя Fe является лучшим выбором для замены положительного электрода PBA, богатого Mn, материалы отрицательного электрода должны быть оптимизированы с высокой емкостью и низким окислительно-восстановительным потенциалом для дальнейшего увеличения плотности энергии AKIB. Кроме того, чтобы снизить стоимость всей батареи и в то же время для обеспечения ее превосходных мощных характеристик и высокого рабочего напряжения, следует изучить менее дорогие соли с высокой растворимостью, такие как снижение концентрации электролита путем изменения интерфейса и использования смешанные вода / неводные растворители.
Рис. 11a Окно электрохимической стабильности 1 м и 22 м KCF 3 SO 3 электролиты при скорости сканирования 10 мВ с -1 при использовании Ti-сетки в качестве токосъемника. b Циклические характеристики PTCDI / K x Fe y Mn 1- y [Fe (CN) 6 ] w · z H 90 O полные ячейки при 4 ° C. Воспроизведено с разрешения Ref.{+} \) ионный аккумулятор был описан Ву и его коллегами в 2017 году с (NH 4 ) 1,47 Ni [Fe (CN) 6 ] 0,88 в качестве положительного электрода и PTCDI (3,4 , 9,10-перилентетракарбоновый диимид) в качестве отрицательного электрода (рис. 12) [61]. Эта батарея имела среднее рабочее напряжение всего 1,0 В и низкую плотность энергии 43 Вт · ч · кг -1 . Водно-аммониевый двухионный аккумулятор с максимальным рабочим напряжением 1,9 В и высокой плотностью энергии 51,3 Вт · ч кг -1 был построен с использованием электродов из органического полимера [62].{+} \) положительные электроды имеют более высокий окислительно-восстановительный потенциал.
Рис. 12a Принципиальная схема работы водных ионных аккумуляторов NH 4 + на основе положительных электродов Prussian White и отрицательных электродов PTCDI. b Кривые заряда-разряда водной NH 4 + -ионной батареи в первом, втором, пятом и десятом циклах (60 мА г −1 ). c Производительность при езде на велосипеде при скорости 3 C [61].Воспроизведено с разрешения Ref. [61]. Авторское право 2017, Wiley – VCH. d Окно электрохимической стабильности 1 M и 25 m AmAc электролитов (1 мВ с -1 ). e Циклические характеристики TiO 1,85 (OH) 0,30 · 0,28H 2 O-электрод в 25 м AmAc (1 A g −1 ) [63]. {+} \) также является эффективным способом увеличения плотности энергии AAIB [64, 65].Наша группа была первой, кто сообщил о водной перезаряжаемой гибридной аммонийно-цинковой батарее (ARAHB), содержащей высокопрочный гексацианоферрат натрия и железа NaFe III Fe II (CN) 6 (Na-FeHCF) положительный электрод нанокубика и низко- недорогой цинковый отрицательный электрод, с рабочим напряжением 1,3 В и высокой плотностью энергии 81,7 Вт · ч. кг −1 (в расчете на общую массу активных материалов) (рис. 12f, g). Затем мы дополнительно увеличили плотность энергии ARAHB до 114 Вт · ч кг -1 , используя наночастицы CuHCF в качестве материала положительного электрода (рис.12h, i).
Водные Zn-ионные батареи (AZIB)
Цинк является наиболее идеальным материалом для отрицательных электродов для водных аккумуляторов из-за его низкого окислительно-восстановительного потенциала (- 0,76 В по сравнению с SHE), высокой удельной емкости (820 мАч г -1 ) , богатые запасы и нетоксичные свойства. Он широко используется в качестве отрицательных электродов в щелочных батареях на основе цинка (таких как щелочные цинк-MnO 2 батареи [66], цинк-никелевые батареи [67, 68] и Zn // Co 3 O 4 батареи [69, 70], воздушно-цинковые батареи [71, 72], ионно-цинковые батареи и гибридные цинковые батареи.В последнее время было много обзоров по этим аспектам, поэтому мы не будем подробно останавливаться на них с точки зрения электродных материалов [73,74,75,76,77,78,79,80,81,82,83,84,85 , 86]. Здесь мы подводим итоги последних достижений в области цинковых батарей с высоким напряжением и высокой плотностью энергии. В Таблице 3 и на Рисунке 13 представлены подробные данные о показателях работы АЗИБ на сегодняшний день.
Таблица 3 Электрохимические свойства различных AZIB, AMIB, ACIB и AAIB с высоким напряжением и плотностью энергии Рис.13Плотность энергии и средняя разрядная емкость различных AZIB, AMIB, ACIB и AAIB с высоким напряжением и плотностью энергии
Zn – MnO 2 батареи на основе водных электролитов на основе слабой соли цинка в настоящее время являются важной темой исследований [87, 88,89]. Несмотря на значительный прогресс, механизм реакции хранения Zn 2+ в материалах на основе Mn остается спорным. Предыдущий обзор суммировал три механизма накопления заряда [73]: (а) обратимое введение / извлечение ионов Zn в объемных материалах; (б) обратимые протонные реакции, сопровождающиеся отложением сульфата гидроксида цинка; и (c) H + и Zn 2+ , которые последовательно внедряются / удаляются на разных стадиях заряда-разряда.Основываясь на этих механизмах (рис. 14a), батарея Zn – MnO 2 использует только емкость и напряжение, обеспечиваемые окислительно-восстановительной реакцией пары Mn 4+ / Mn 3+ , ограничивая емкость батареи и выходную мощность. Напряжение. Это выдвигает новые требования к электрохимии цинка и марганца. Поскольку ион Mn поливалентен (+2, +3 и +4), двухэлектронная реакция Mn 4+ / Mn 2+ емкостью 616 мА г −1 и платформа более высокого напряжения можно постулировать.Недавно был предложен новый механизм, который включает обратимое осаждение / растворение Mn 2+ / MnO 2 , химическое превращение (между MnO 2 и MnOOH) и вставку Zn 2+ [90]. На основе уникальной двухэлектронной окислительно-восстановительной реакции Mn 4+ / Mn 2+ была собрана высоковольтная электролитическая цинково-марганцевая батарея с высоким разрядным плато 1,95 В и высокой плотностью энергии 409 Вт · ч · кг. −1 , а также отличные характеристики при циклировании (сохранение емкости 92% после 1800 циклов) (рис.14б, в).
Рис. 14a Схема трехступенчатых процессов гальваностатического разряда. b Кривые гальваностатического разряда. c Циклические характеристики при 30 мА см −2 . Zn – MnO 2 электролитические ячейки заряжаются при постоянном напряжении 2,2 В (по сравнению с Zn / Zn 2+ ) [91]. Воспроизведено с разрешения Ref. [91]. Copyright 2017, Американское химическое общество)
Для дальнейшего увеличения напряжения и плотности энергии Zn-MnO 2 батареи мы можем использовать гибридный электролит с разными значениями pH, например щелочно-нейтральный электролит и щелочно-кислотный электролит.Недавно наша группа сообщила о батарее Zn // MnO 2 с щелочным (1 M NaOH и 0,01 M Zn (Ac) 2 ) -нейтральным (2 M ZnSO 4 + 0,1 M MnSO 4 ) гибридом. электролит и мембрана Na + -Nafion от DKJ Co. Ltd. Принцип ее работы показан на рис. 15а. Использование Zn / Zn (OH) 2− 4 отрицательный электрод в щелочном растворе, который имеет относительно низкий окислительно-восстановительный потенциал, напряжение батареи значительно увеличивается.Аккумулятор в сборе имеет среднее плато разрядного напряжения 1,7 В и удельную энергию 487 Вт · ч · кг −1 [92]. Кроме того, за счет объединения двух окислительно-восстановительных реакций электрода растворения / осаждения MnO 2 / Mn 2+ и Zn / Zn (OH) 2− 4 с использованием двойных кислотно-щелочных электролитов и ионоселективной мембраны была сконструирована высокоэнергетическая батарея Zn-MnO 2 [93]. Рабочий механизм показан на рис. 15б.При зарядке Zn (OH) 2− 4 восстанавливается до Zn, а Mn 2+ окисляется до MnO 2 . В то же время катионы (K + ) и анионы (SO 4 2−), хранящиеся в BPM, возвращаются к положительному и отрицательному электродам соответственно, достигая баланса заряда. В процессе разряда эти два процесса развиваются в противоположном направлении. Батарея Zn – Mn 2+ имела высокое рабочее напряжение 2.44 В, высокий кулоновский КПД 98,4% и сохранение разрядной емкости 97,5% после 1500 циклов. В частности, его удельная энергия чрезвычайно высока (≈ 1503 Вт · ч · кг -1 , рассчитано на основе материала положительного электрода), что является самым высоким показателем среди всех водных аккумуляторов на основе цинка, о которых сообщалось до сих пор, и даже сравнимо с таковыми из Zn- воздушные батареи.
Рис. 15a Принципиальная схема разработанной водной цинково-марганцевой батареи [92]. Воспроизведено с разрешения [92].Авторское право 2020, Американское химическое общество. b Принципиальная схема и механизм Zn – MnO 2 батареи, использующей двойной кислотно-щелочной электролит в условиях заряда и разряда. [93] Воспроизведено с разрешения Ref. [93]. Copyright 2020, Wiley – VCH
PBAимеют трехмерный открытый каркас и большую щелевую структуру и считаются обратимыми материалами-хозяевами интеркаляции / деинтеркаляции Zn 2+ с быстрой зарядкой и разрядкой, высоким рабочим потенциалом и идеальным электрохимические свойства.В материалах электродов на основе ПБА обычно только один ион переходного металла (в большинстве случаев железо) считается электрохимически активным в системе водного электролита, что приводит к его ограниченной удельной емкости в водном растворе Zn 2+ (≈ 60 мАч г −1 ), тогда как в большинстве случаев напряжение низкое (~ 1,2 В Zn / Zn 2+ ), и поэтому удельная энергия батареи мала. Недавно был разработан новый вид кубиков Co / Fe PBA (гексацианоферрат кобальта, CoFe (CN) 6 ), в которых ожидается, что ионы Co и Fe будут эффективно участвовать в процессе двухэлектронного накопления энергии, что приведет к усилению удельной емкости [94].Как проиллюстрировано на фиг. 16a, вакансии, образованные в результате извлечения ионов K из каркаса CoFe (CN) 6 , имеют тенденцию отдавать предпочтение интеркаляции Zn 2+ . Интеркаляция / деинтеркаляция Zn 2+ требует двух стадий из-за разной энергии активации активных пар Co (III) / Co (II) и Fe (III) / Fe (II), что подтверждается кривыми CV (рис. . 16b). Собранная батарея Zn / CoFe (CN) 6 не только имела отличную скорость и циклические характеристики, но также работала на плато 1.75 В (рис. 16c) и показала плотность энергии 250 Вт · ч · кг -1 .
Рис. 16a Принципиальная схема обратимой интеркаляции / деинтеркаляции Zn 2+ в структуре CoFe (CN) 6 во время процессов зарядки и разрядки. b Первые три цикла кривых CV (1 мВ с -1 ). c Кривые постоянного тока заряда-разряда при различных плотностях тока [94]. Воспроизведено с разрешения Ref. [94]. Авторское право 2019, Wiley – VCH. d Принципиальная диаграмма взаимосвязи между энергией и плотностью состояний (DOS) в Co 0,247 V 2 O 5 · 0,944H 2 O и V 2 O 5 · n H 2 O положительные электроды. Воспроизведено с разрешения Ref. [102]. Copyright 2019, Wiley – VCH
Оксиды на основе ванадия, которые обладают несколькими степенями окисления и высокой емкостью (> 300 мАч г −1 ), широко используются в качестве материалов положительных электродов для водных цинк-ионных аккумуляторов.Существуют различные оксиды на основе ванадия, которые обеспечивают значительную емкость и отличную циклическую стабильность, которые интенсивно изучаются, такие как V 2 O 5 · n H 2 O [95], NaV 3 O 8 · 1,5H 2 O [96], Ca 0,24 V 2 O 5 · 0,83H 2 O [97], H 2 V 3 O 8 [98, 99], K 2 V 6 O 16 · 2,7H 2 O [100] и ванадат алюминия [101].Однако неприятным аспектом является то, что 80% их емкости находится ниже 1,0 В, что приводит к низкой плотности энергии (<250 Вт · ч кг -1 ), что резко контрастирует с их большой емкостью. Чжи и его коллеги сообщили о цинк-ионной батарее на основе положительного электрода с нанолентой Co 0,247 V 2 O 5 · 0,944H 2 O, обеспечивающего 52,5% общей емкости свыше 1,0 В и, следовательно, была получена высокая плотность энергии 432 Втч кг −1 [102].Результаты показывают, что большая емкость Co 0,247 V 2 O 5 · 0,944H 2 O обусловлена его более высокой адсорбционной способностью для Zn 2+ , а высокое напряжение батареи в основном из-за взаимодействия между орбиталями Co 3d и V 3d , которое перемещает относительный окислительно-восстановительный потенциал пары V 5+ / V 4+ на более высокий уровень (рис. 16d).
Материалы типа NASICON имеют большие каналы и способность к быстрой диффузии ионов и очень привлекательны в качестве узлов хранения Zn 2+ -ion.Na 3 В 2 (PO 4 ) 3 был зарегистрирован как положительный электрод водной Zn-ионной батареи с напряжением 1,1 В, 97,5 мАч г -1 ёмкость, но недостаточная цикличность (сохранение 74% емкости после 100 циклов) [103]. Недавно сообщалось, что другой материал типа NASICON, Na 3 V 2 (PO 4 ) 2 F 3 , является высоковольтным положительным электродом (более 1,6 В) для ионов цинка. аккумулятор, с окислительно-восстановительным потенциалом 0.На 5 В выше, чем у Na 3 V 2 (PO 4 ) 3 [104]. Цинк-ионная батарея в сборе имеет высокий потенциал 1,62 В и высокую плотность энергии 97,5 Вт · ч кг −1 (рис. 17a). Что еще более важно, при плотности тока 1 A g -1 цинк-ионная батарея показала очень стабильную производительность при циклической работе, сохраняя 95% емкости в течение 4000 циклов (рис. 17b).
Рис.17a Кривые заряда-разряда первых трех циклов CFF-Zn // Na 3 V 2 (PO 4 ) 2 F 3 @C батареи ( 0.08 A g −1 ). b Циклические характеристики CFF-Zn (углеродная пленка, функционализирующая Zn) // Na 3 V 2 (PO 4 ) 2 F 3 @C батареи (1 A g −1 ) [104]. Воспроизведено с разрешения Ref. [104]. Copyright 2018, Elsevier BV Сравнение производительности Zn / Co (III) rich-Co 3 O 4 батареи в 1 M KOH и 2 M ZnSO 4 с 0,2 M CoSO 4 : a заряд-разряд кривые, b производительность первых 500 циклов (1 A g −1 ) [105].Воспроизведено с разрешения Ref. [105]. Авторское право 2018, Королевское химическое общество
Как правило, в цинково-кобальтовых батареях используется щелочной электролит, который демонстрирует плохую устойчивость к циклическим нагрузкам и вызывает загрязнение окружающей среды. Окислительно-восстановительная реакция между CoO и Co 3 O 4 была обнаружена в батарее Zn / Co 3 O 4 с мягким водным электролитом [105]. Слой CoO, сформированный во время процесса разряда, показывает процесс преобразования вставки ионов H + в Co 3 O 4 .Батарея с высоким содержанием Zn / Co (III) Co 3 O 4 , использующая слабый водный электролит, показала окно напряжения около 2,2 В (рис. 17c, d), что намного шире, чем у батареи с щелочными электролитами ( около 1,9 В).
Водные магниево-ионные аккумуляторы (AMIB)
Магниево-ионные аккумуляторы постепенно становятся еще одной популярной областью исследований, поскольку ресурсы Земли богаты магнием, который недорого стоит и подходит для разработки устройств хранения энергии.Ион магния похож на ион лития. Однако основные проблемы, связанные с неводными перезаряжаемыми Mg-ионными батареями, препятствуют их развитию: (а) их электролит чувствителен к воде и имеет сложные химические свойства; (б) отсутствие высокоэффективных электродных материалов также ограничивает практическую применимость Mg-батарей из-за медленной диффузии Mg 2+ в твердых телах. Напротив, водные магниево-ионные батареи (AMIB) имеют много преимуществ, таких как низкая стоимость, отсутствие коррозии, хорошая безопасность и хорошая проводимость.Однако из-за отсутствия подходящих материалов для отрицательного и положительного электрода большинство заявленных электродных материалов для AMIB оценивались только на полуэлементной установке. Ограниченные окном стабильности напряжения традиционных водных электролитов (1,23 В), напряжение и плотность энергии AMIB также очень ограничены [106]. Общеизвестно, что Mg вряд ли может быть осажден и удален обратимо в водном растворе, поскольку Mg является активным металлом и имеет низкий окислительно-восстановительный потенциал (-2,37 В противОНА). Недавние исследования показали, что обратимое осаждение / удаление металлического магния в электролите, содержащем H 2 O, возможно путем введения искусственной твердой поверхности раздела. Наша группа сообщила о гибридной батарее Mg / LiFePO 4 , в которой реактив Гриньяра на основе магния применялся в качестве отрицательного электрода для неводного электролита, а LISICON служил в качестве комбинированного сепаратора / твердого электролита. Эта гибридная батарея продемонстрировала среднее напряжение разряда 2,1 В, стабильное плато разряда и хорошие циклические характеристики (рис.18а – в) [107].
Рис. 18a Схематическое изображение водной батареи Mg / LiFePO 4 . b Кривая заряда – разряда первого цикла (50 мАч г –1 , 1,7–3,4 В). c Циклические характеристики (50 мАч g −1 , 1,7–3,4 В) [107]. Воспроизведено с разрешения Ref. [107]. Авторские права 2015, Издательская группа Nature. d Сравнение циклических характеристик Mg / V 2 O 5 и Mg (с межфазной защитой) / V 2 O 5 in 0.5 M Mg (TFSI) 2 / PC электролиты без / с водой. e Кривые заряда-разряда для Mg / V 2 O 5 и Mg (с межфазной защитой) / V 2 O 5 в 0,5 M Mg (TFSI) 2 / PC + 3 MH 2 O электролитов (0,5–2,5 В, 29,4 мА г –1 ). Воспроизведено с разрешения Ref. [108]. Copyright 2018, Nature Publishing Group
Недавно искусственная Mg 2+ -проводящая межфазная поверхность на поверхности отрицательного электрода из Mg была синтезирована термоциклированием полиакрилонитрила и Mg (OTf) 2 .Искусственная межфазная фаза позволила осуществить обратимое циклирование полной ячейки Mg / V 2 O 5 в водосодержащем электролите на основе карбоната (рис. 18d, e) [108]. В таблице 3 и на рис. 18 приведены подробные сведения о производительности AMIB, о которых сообщалось на сегодняшний день.
Водные Ca-ионные батареи (ACIB)
Химические свойства Ca 2+ очень похожи на свойства Mg 2+ . Хотя радиус катиона Ca 2+ (0,100 нм) больше, чем у Li + (0.076 нм) и катионов Mg 2+ (0,072 нм), его окислительно-восстановительный потенциал низкий (–2,87 В по сравнению с SHE), богат запасами и низкая плотность ионного заряда, что делает его альтернативным анодным материалом для пост-литий-ионных полимеров. ионные батареи. ACIB также является потенциальной электрохимической системой. Известно немного материалов для электродов с интеркаляцией кальция, в основном из-за медленной диффузии Ca 2+ . В настоящее время немногочисленные материалы положительных электродов для ACIB, о которых сообщается, в основном представляют собой ПБА [включая NiHCF [109], K 2 BaFe (CN) 6 [110] и CuHCF [111]], а указанные отрицательные материалы в основном являются органическими. электродные материалы, такие как PNDIE {поли- [N, N ‘- (этан-1,2-диил) -1,4,5,8-нафталинтетракарбоксиимид]} [112].
До сих пор сообщалось только об одном ACIB, состоящем из отрицательного электрода PNDIE и PBA, гексацианоферрата меди {CuHCF, K 0,02 Cu [Fe (Cu) 6 ] 0,66 · 3,7H 2 O }, в качестве положительного электрода и водный раствор Ca (NO 3 ) 2 в качестве электролита (рис. 19) [112]. Полная батарея продемонстрировала удельную емкость 40 мАч g −1 при 1 ° C (1 C = 40 мАч g −1 ) со средним рабочим напряжением 1,24 В, что соответствует плотности энергии 54 Втч кг — 1 , и сохранение емкости 88% с почти 100% кулоновским КПД после 1000 циклов при 10 ° C.
Рис. 19a Принципиальная схема заряда и разряда водной перезаряжаемой ионно-кальциевой батареи (PNDIE // Ca 0,3 CuHCF). b CV-кривые электродов и электрохимическая стабильность электролита [2,5 M Ca (NO 3 ) 2 , 1 мВ с -1 ]. c График зависимости напряжения от времени для аккумуляторов PNDIE // Ca 0,3 CuHCF (450 мАч g −1 ). d Циклические характеристики PNDIE // Ca 0.3 батареи CuHCF (400 мАч г -1 ). Воспроизведено с разрешения Ref. [112]. Copyright 2017, Wiley – VCH
Водные алюминиево-ионные батареи (AAIB)
Алюминий обладает высокой удельной объемной емкостью (8046 мАч см −3 ) и высокой гравиметрической емкостью (2980 мАч g −1 ), что составляет сравним с металлическим литием, имеет высокое содержание (около 8 мас.% земной коры) и является самым дешевым в производстве, за исключением железа. Кроме того, металлический алюминий имеет лучшую стабильность на воздухе, чем литий, что снижает потенциальные риски для безопасности, а также является экологически чистым.Введение ионных жидкостей при комнатной температуре (RTIL) с широким электрохимическим окном стабильности улучшило обратимость процесса удаления / нанесения покрытия из Al — прорыв, открывший жизнеспособный путь для перезаряжаемых алюминиево-ионных батарей (AIB) [113, 114, 115]. В последние годы успешное приготовление новых электролитов и лучшее понимание природы SEI привело к разработке AAIB [116, 117]. Многие исследователи исследовали новые электродные материалы для AAIB, такие как TiO 2 [118,119,120,121], MoO 3 [122, 123], WO 3 [124], FeVO 4 [125] и PBA [126,127,128]) , и некоторые обзоры всесторонне резюмировали эту работу [129,130,131,132].Поэтому мы обсудим этот аспект лишь кратко и сосредоточимся на недавнем прогрессе в исследованиях высокоэнергетических перезаряжаемых AAIB на основе металлического алюминия. В таблице 3 представлены подробные сведения о производительности AAIB, о которых сообщалось на сегодняшний день.
Использование алюминия в качестве отрицательного электрода AAIB — захватывающий прорыв. 5 м водный раствор трифторметансульфоната алюминия [Al (OTf) 3 ] описан как электролит с потенциальным окном от — 0,3 до 3,3 В (по сравнению с Al 3+ / Al) и способностью получать обратимое осаждение / удаление алюминий (рис.20) [116]. На основе этого электролита AAIB был собран с отрицательным электродом из металла Al и положительным электродом из Al x MnO 2 · n H 2 O, который имел средний потенциал (1,1 В) и выдающаяся плотность энергии 481 Втч кг −1 [117].
Рис.20a Окно электрохимической стабильности 5 м водного раствора Al (OTF) 3 (стеклоуглерод, 10 мВ с −1 ). b Кривая постоянного тока заряда-разряда симметричного элемента Al – Al (5 м Al (OTF) 3 ). c Кривая заряда-разряда первых пяти циклов батареи Al-MnO 2 . d Циклические характеристики батареи Al – MnO 2 . Воспроизведено с разрешения Ref. [117], Copyright 2019 Nature Publishing Group
Хорошо известно, что пассивирующий слой Al 2 O 3 быстро и необратимо образуется на поверхности металлического Al в воздухе, что препятствует усилиям по превращению воды в воду с высокой степенью обратимости. электрохимические ячейки на основе алюминия.Недавно сообщалось, что обогащенная ионной жидкостью (ИЖ) межфазная фаза на поверхности Al может быть получена путем погружения Al в кислый электролит ИЖ, состоящий из AlCl 3 — [EMIm] Cl, более чем на 1 день, что приводит к коррозии пассивирующая пленка из Al 2 O 3 и предотвращала ее последующее образование [117]. Кроме того, этот вид интерфейса является постоянным и способствует миграции Al 3+ . Используя этот искусственный SEI, T – Al (анод из алюминия, обработанный IL) // MnO 2 водная батарея была создана с использованием водного Al (CF 3 SO 3 ) 3 электролитов, которые могли быть переработан и не показал значительного выделения водорода.Этот AAIB показал среднее напряжение 1,37 В и напряжение плато 1,40 В, обеспечивая удельную энергию около 500 Вт · ч · кг -1 (рис. 21). Характеристики были дополнительно улучшены за счет предварительного добавления 0,5 м MnSO 4 в водный электролит Al (OTf) 3 , который аналогичен батарее Zn / MnO 2 , где соль Mn 2+ улучшает оба емкость и циклические характеристики электрода из оксида марганца [133]. Эта батарея T-Al / 0,5Mn / Bir-MnO 2 продемонстрировала замечательную плотность энергии (620 Вт · ч · кг -1 на основе массы MnO 2 типа бирнессита) и высокую сохраняющуюся емкость.
Рис. 21СЭМ-изображение Al фольги (слева) и фольги T – Al (справа). b Кривая постоянного тока для заряда-разряда симметричных элементов Al – Al и T – Al / T – Al [2 м Al (CF 3 SO 3 ) 3 ]. Воспроизведено с разрешения Ref. [116]. Авторское право 2018, AAAS. c Кривые гальваностатического разряда / заряда водных алюминиевых батарей [2 м Al (CF 3 SO 3 ) 3 , 100 мА г -1 ]. d Вторые кривые разряд – заряд при постоянном токе для Al / Bir-MnO 2 , T – Al / Bir-MnO 2 и T – Al / 0.5Mn / Bir-MnO 2 батареи (100 мАч г −1 ). e Циклические характеристики батарей T – Al / Bir-MnO 2 и T – Al / 0,5Mn / Bir-MnO 2 . Воспроизведено с разрешения Ref. [133]. Copyright 2019, Wiley – VCH
WiS водный AlCl 3 в качестве электролитов был применен для создания AAIB на основе металлического Al, состав которого смог снизить начальный потенциал реакции выделения водорода до прибл. –2,3 В (по сравнению с Ag / AgCl), что позволило Al 3+ осесть на алюминиевый отрицательный электрод и расширить окно электрохимической стабильности AAIB примерно до 4 В [134].На основе этого электролита был успешно собран алюминиево-графитовый аккумулятор с высокой удельной емкостью до 165 мАч g −1 , превосходной стабильностью с сохранением емкости почти 99% и удельной энергией 220 Втч кг −1 . (Рис.22).
Рис. 22a Принципиальная схема алюминиево-графитовой батареи во время разряда. b Кривые постоянного тока заряда-разряда алюминиевых графитовых ячеек при различных плотностях тока. c Циклические характеристики алюминиевых графитовых батарей (500 мА г -1 ).Воспроизведено с разрешения Ref. [134]. Авторское право 2019, Королевское химическое общество
Из-за ограниченной растворимости Al (OTf) 3 в воде очень трудно получить аналогичный электролит WiS для AAIB. Однако другие хорошо растворимые соли, такие как LiTFSI, могут быть введены для образования электролитов WiS. Например, смешанный электролит, содержащий 1 м Al (OTf) 3 + 17 м LiTFSI + 0,02 м HCl, был использован для создания перезаряжаемой водной Al – S батареи [135]. В этом смешанном электролите сверхконцентрированный LiTFSI не только ингибировал гидролиз полисульфида на положительном электроде, но также уменьшал побочную реакцию выделения водорода на отрицательном электроде, в то время как добавка HCl предотвращала образование пассивирующего слоя на поверхности отрицательного электрода.Собранная батарея Al – S имела начальную емкость 1410 мАч г -1 (в пересчете на массу серы) и сохраняла обратимую емкость 420 мАч г -1 после 30 циклов с приемлемой кулоновской эффективностью 97% ( Рис.23).
Рис. 23a Гальваностатические кривые заряда – разряда первых двух циклов Al ofAl (OTf) 3 + LiTFSI + HCl‖S / C (200 мА г −1 ). b Циклические характеристики аккумуляторов AlAl (OTf) 3 + LiTFSI + HCl‖S / C (200 мА г −1 ).Воспроизведено с разрешения Ref. [135]. Авторское право 2020, Королевское химическое общество
Как предотвратить короткое замыкание в литиевых батареях нового поколения | MIT News
По мере того как исследователи раздвигают границы дизайна батарей, стремясь упаковать все большее количество мощности и энергии в заданное пространство или вес, одной из наиболее многообещающих изучаемых технологий являются литий-ионные батареи, в которых используется материал твердого электролита между ними. два электрода, а не типичная жидкость.
Но такие батареи страдают из-за тенденции к образованию ветвистых металлических выступов, называемых дендритами, на одном из электродов, которые в конечном итоге перекрывают электролит и замыкают аккумуляторную батарею. Теперь исследователи из Массачусетского технологического института и других организаций нашли способ предотвратить такое образование дендритов, потенциально раскрывая потенциал этого нового типа мощных батарей.
Результаты описаны в журнале Nature Energy , в статье аспиранта Массачусетского технологического института Ричарда Парка, профессоров Йет-Минг Чанга и Крейга Картера и еще семи человек из Массачусетского технологического института, Техасского университета A&M, Университета Брауна и Университета Карнеги-Меллона.
Твердотельные батареи, объясняет Чианг, были давно востребованной технологией по двум причинам: безопасность и плотность энергии. Но, по его словам, «единственный способ достичь интересной плотности энергии — это использовать металлический электрод». И хотя можно соединить этот металлический электрод с жидким электролитом и при этом получить хорошую плотность энергии, это не дает такого же преимущества в безопасности, как твердый электролит, говорит он.
По его словам, твердотельные батареиимеют смысл только с металлическими электродами, но попытки разработать такие батареи были затруднены из-за роста дендритов, которые в конечном итоге перекрывают зазор между двумя электродными пластинами и замыкают цепь, ослабляя или деактивируя эту ячейку. в батарее.
Известно, что дендриты образуются быстрее, когда ток выше, что обычно желательно для обеспечения быстрой зарядки. До сих пор плотность тока, которая была достигнута в экспериментальных твердотельных батареях, была намного меньше той, которая потребовалась бы для практической коммерческой перезаряжаемой батареи. Но обещание стоит того, говорит Чан, потому что количество энергии, которое может храниться в экспериментальных версиях таких элементов, уже почти вдвое больше, чем у обычных литий-ионных батарей.
Команда решила проблему дендритов, приняв компромисс между твердым и жидким состояниями. Они сделали полутвердый электрод, контактирующий с твердым электролитическим материалом. Полутвердый электрод обеспечивал своего рода самозаживляющуюся поверхность на границе раздела, а не хрупкую поверхность твердого тела, которая могла приводить к крошечным трещинам, которые обеспечивали начальные зародыши для образования дендритов.
Идея была вдохновлена экспериментальными высокотемпературными батареями, в которых один или оба электрода состоят из расплавленного металла.По словам Парка, первого автора статьи, температуры в сотни градусов расплавленных металлических батарей никогда не будут практичными для портативного устройства, но работа продемонстрировала, что жидкостная граница раздела может обеспечивать высокие плотности тока без образования дендритов. . «Мотивом здесь была разработка электродов на основе тщательно отобранных сплавов с целью введения жидкой фазы, которая может служить самовосстанавливающимся компонентом металлического электрода», — говорит Парк.
Этот материал более твердый, чем жидкость, объясняет он, но напоминает амальгаму, которую стоматологи используют для заполнения полости — твердый металл, но все же способный течь и принимать форму.При обычных температурах, при которых работает аккумулятор, «он остается в режиме, в котором есть как твердая фаза, так и жидкая фаза», в данном случае состоящая из смеси натрия и калия. По словам Чанга, команда продемонстрировала, что можно запустить систему при токе в 20 раз большем, чем при использовании твердого лития, без образования дендритов. Следующим шагом было воспроизвести эту работу с реальным литийсодержащим электродом.
Во второй версии своей твердой батареи команда ввела очень тонкий слой жидкого натрий-калиевого сплава между твердым литиевым электродом и твердым электролитом.Они показали, что этот подход может также решить проблему дендритов, обеспечивая альтернативный подход для дальнейших исследований.
Новые подходы, по словам Чанга, можно легко адаптировать ко многим различным версиям твердотельных литиевых батарей, которые исследуются исследователями по всему миру. Он говорит, что следующим шагом команды будет демонстрация применимости этой системы к различным архитектурам батарей. Соавтор Вишванатан, профессор машиностроения в Университете Карнеги-Меллона, говорит: «Мы думаем, что сможем применить этот подход к действительно любой твердотельной литий-ионной батарее.Мы думаем, что его можно сразу использовать при разработке ячеек для широкого спектра приложений, от портативных устройств до электромобилей и электрической авиации ».
«Проникновение металла через сепараторы твердого электролита — ключевая проблема, с которой сталкиваются батареи с высокой плотностью энергии, и на сегодняшний день большое внимание уделяется свойствам материала сепаратора, через который проникает металл», — говорит Пол Альбертус, доцент кафедры химии. и биомолекулярная инженерия в Университете Мэриленда, который не участвовал в этом исследовании.Отмечая, что в новой работе основное внимание уделяется свойствам самого металлического электрода, он говорит, что исследование «важно как для установления научных приоритетов для понимания проникновения металла, так и для разработки инноваций, которые помогут смягчить этот важный вид отказа».
В команду также входили Кристофер Эшлер, Коул Финчер и Андрес Бадель из Массачусетского технологического института; Пинвен Гуан из Университета Карнеги-Меллона; и Брайан Шелдон из Университета Брауна.