Дистиллированную воду или электролит: что доливать в аккумулятор
Правильный уровень электролитической жидкости во много определяет срок службы аккумулятора. Но следить нужно и за уровнем, и за плотностью раствора серной кислоты. В статье мы ответим на вопрос, что заливать, как отличить дистиллированную воду от обычной, чтобы своими действиями не сократить ресурс АКБ.
Почему АКБ нуждается в обслуживании?
data-full-width-responsive=»true»>
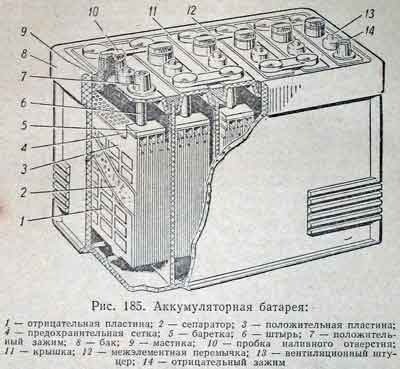
Электролит — смесь серной кислоты и дистиллированной воды, которая вступает в химическую реакцию с активной массой отрицательных и положительных пластин. При разряде свинцово-кислотного аккумулятора из электролитической жидкости расходуется серная кислота и вода, в результате чего снижается плотность электролита. При обратном процессе, когда аккумулятор заряжается, количество свинца на электродах может снизиться настолько, что внутри батареи начинает преобладать процесс электролиза воды. Описанное выше «кипение» возникает при перезаряде аккумулятора, а результатом выделения газообразного водорода и кислорода становится повышение плотности электролита.
Перезаряд опасен не только выкипанием воды, но и взрывом образующихся внутри корпуса аккумулятора газов. Поэтому нужно следить за исправностью системы зарядки автомобиля. В случае заряда от внешнего устройства следует приоткрутить сервисные пробки и правильно выставлять ток зарядки.
Подготовленный материал главным образом относится к малосурмянистым свинцово-кислотным аккумуляторам (Sb/Sb). АКБ такого типа из-за невысокой стоимости получили наибольшее распространение, но владельцам стоит помнить о недостатках: высокий саморазряд и снижение плотности вследствие вскипания воды. Некоторые кальциевые аккумуляторные батареи (Ca/Ca) также нуждаются в плановом обслуживании, что обязательно указывает производитель в инструкции по эксплуатации.
В каких случаях следует долить электролит?
- Линейный перезаряд. Причина в неисправной системе зарядки автомобиля, вследствие чего происходит вскипание электролитической жидкости. Проверить систему зарядки можно мультиметром.
 Уровень заряда на холостом ходу и при перегазовках не должен превышать 14,8 В. Если вы заметили на корпусе потеки и окисление на металлических поверхностях вблизи батареи, после устранения причины неисправности обязательно проверьте уровень и плотность электролитической жидкости. Продолжительная эксплуатация АКБ при перезаряде опасна оголением пластин, вследствие чего они нагреваются и теряют активную массу, происходит реакция сульфатации. На внутренней части пробок при этом можно увидеть темный налет. Лучше не пытаться оживить батарею доливкой электролита, а заменить аккумулятор.
Уровень заряда на холостом ходу и при перегазовках не должен превышать 14,8 В. Если вы заметили на корпусе потеки и окисление на металлических поверхностях вблизи батареи, после устранения причины неисправности обязательно проверьте уровень и плотность электролитической жидкости. Продолжительная эксплуатация АКБ при перезаряде опасна оголением пластин, вследствие чего они нагреваются и теряют активную массу, происходит реакция сульфатации. На внутренней части пробок при этом можно увидеть темный налет. Лучше не пытаться оживить батарею доливкой электролита, а заменить аккумулятор. - Течь электролита из одной из банок вследствие повреждения корпуса. Трещины, сколы чаще всего возникают из-за механических повреждений или замерзания воды внутри корпуса в сильный мороз. Если степень повреждений незначительная, корпус можно отремонтировать. В таком случае следует правильно определить соотношение электролита и дистиллированной воды в аккумуляторе. Если аккумулятор был поврежден до использования, надо залить электролит с такой же плотностью, которая осталась в поврежденной банке.

- Потеря электролита вследствие переворота или опрокидывания батареи.
- Ввод в эксплуатацию сухозаряженных аккумуляторов. Данная технология производства сохранила свою актуальность только для мотоциклов. Все автомобильные аккумуляторные батареи поставляются в готовом к использованию состоянии.
Измеряем плотность и уровень электролита
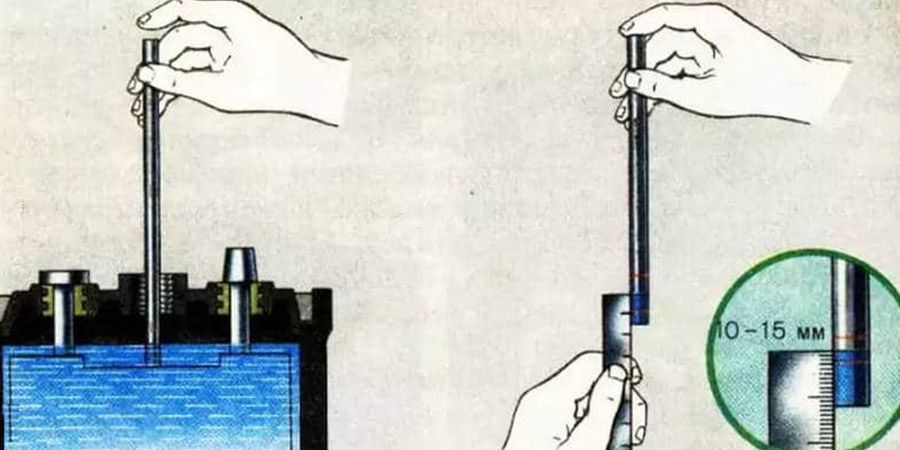
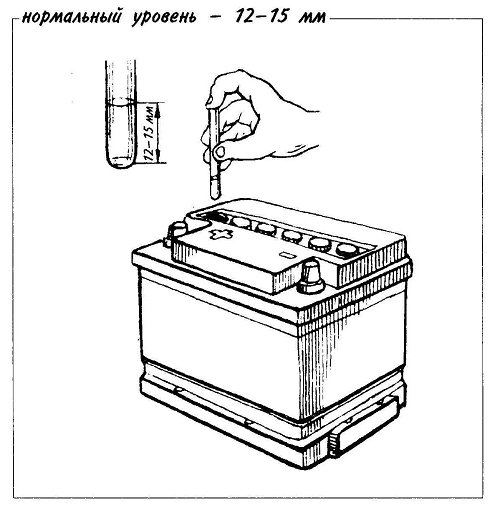
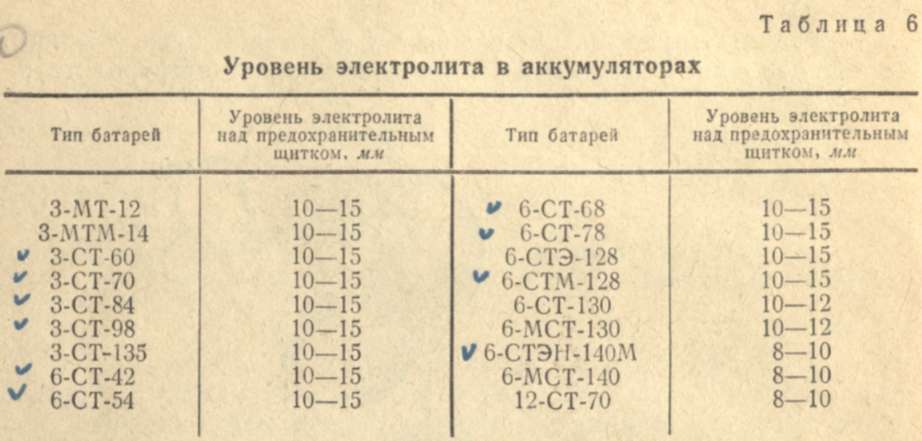
Чтобы понять, вашему аккумулятору нужна вода или электролит, важно правильно определить уровень жидкости и плотность внутри каждой банки. Уровень электролита не должен опускаться ниже верхней границы пластин. Для его визуальной проверки достаточно открутить сервисные пробки.
Шаг второй – измерение плотности. На полностью заряженном аккумуляторе плотность электролитической жидкости с температурой +20 °С должна составлять 1,27-1,29. Измерения проводятся специальным прибором – ареометром. Плотность зависит от температуры электролитической жидкости, поэтому при самостоятельной проверке в условиях, разнящихся с эталонными, следует пользоваться корректирующей таблицей. Суть диагностики в том, чтобы набрать небольшое количество электролита из каждой банки, после чего оценить плотность по шкале на поплавке.
Плотность зависит от температуры электролитической жидкости, поэтому при самостоятельной проверке в условиях, разнящихся с эталонными, следует пользоваться корректирующей таблицей. Суть диагностики в том, чтобы набрать небольшое количество электролита из каждой банки, после чего оценить плотность по шкале на поплавке.
При продолжительном простое в разряженном состоянии аккумулятор следует заряжать малым током (5-7% от емкости). Большой ток зарядки приведет к реакции сульфатации. Даже при полной зарядке АКБ больше не будет соответствовать своим пусковым и емкостным характеристикам.
При сульфатации даже в заряженном состоянии плотность может не подняться выше 1,20. Такие изменения часто вводят автовладельцев в заблуждение, заставляя доливать корректирующий электролит, что неправильно. Сначала нужно провести детацию пластин. Определить можно по белому налету на пластинах.
Если реакция детации отсутствует, то показатель ниже 1,27 говорит о необходимости заливки корректирующего электролита. И наоборот, если плотность выше, следует долить в аккумулятор воды.
И наоборот, если плотность выше, следует долить в аккумулятор воды.
Выбор дистиллята
Если заправить аккумулятор обычной водой (в том числе и собранной дождевой), активная масса пластин очень быстро придет в негодность. Чтобы продлить срок эксплуатации аккумулятора, используйте только качественную дистиллированную воду. Для проверки качества учитывайте простейшие характеристики дистиллята:
- электропроводность. Дистиллированная вода, в отличие от обычной, не проводит электрический ток. Проверить воду можно путем измерения сопротивления с помощью мультиметра – у дистиллята оно будет равно бесконечности;
- отсутствие следов после вскипания. Для теста капните воду на чистый лист А4 либо нагрейте ее на стеклянной поверхности/кусочке фольги. После испарения дистиллята на поверхности не должно остаться ореолов и пятен.
Видео:КАК ДОЛИВАТЬ ЭЛЕКТРОЛИТ ИЛИ ВОДУ В АККУМУЛЯТОР | ЧТО ДЕЛАТЬ НЕЛЬЗЯ
Соотношение электролита к воде
Чтобы получить 1 литр электролитической жидкости плотностью 1,27-1,28, следует смешать 0,772 л корректирующего электролита и 0,295 л дистиллированной воды.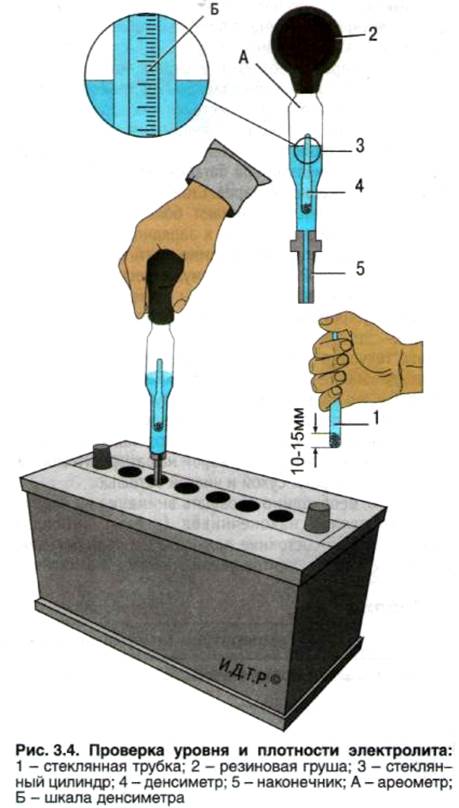 При нормальной эксплуатации испаряется только вода, поэтому доливать электролит вместо дистиллята нельзя. Чтобы не ошибиться с плотностью, обслуживание проводят только после полной зарядки аккумулятора.
При нормальной эксплуатации испаряется только вода, поэтому доливать электролит вместо дистиллята нельзя. Чтобы не ошибиться с плотностью, обслуживание проводят только после полной зарядки аккумулятора.
Перелив воды, при котором плотность опускается на уровень 1,26, считается некритичным. При снижении этой границы уже необходимо откачать часть жидкости, довести плотность до заводской, долив корректирующий электролит.
Меры предосторожности
Все действия с раствором серной кислоты и воды проводят в плотных резиновых перчатках. Не допускайте попадания электролита на оголенные участки кожи и слизистые оболочки. Помните о том, что раствор крайне агрессивен и к лакокрасочному покрытию автомобиля. При попадании на ЛКП обязательно промойте участки очистителем и большим количеством воды.
Плотность электролита в аккумуляторе — какая плотность должна быть и как проверить
Автор Milavlad На чтение 6 мин. Просмотров 12 Опубликовано
Большинство автолюбителей не раз были знакомы с низкой плотью электролита. Проще говоря, проблема разряженного аккумулятора касалась практически каждого второго автовладельца.
Проще говоря, проблема разряженного аккумулятора касалась практически каждого второго автовладельца.
Нормальное показание плотности электролита
Электролит проводит электрический ток и имеет в своём составе дистиллированную воду и серную кислоту. Данные вещества находятся приблизительно в одинаковых долях. На одну часть приходится дистиллированная вода и 1,25 части серной кислоты. Таким образом нормальная плотность аккумулятора составляет 1,25.
Постоянно полуразряженный или полностью разряженный аккумулятор приводит к сульфатации пластин. Это бесповоротно убивает АКБ, снижая его ёмкость и увеличивая внутреннее сопротивление. В процессе сульфатации, пластины аккумулятора покрываются сернокислым крупнокристаллическим свинцом.
Всегда следует:
- Делать периодическую профилактику вашего аккумулятора.
- Взять за правило поддерживать заряд и чистоту аккумуляторной батареи.
- Устранять наличие окислов на клеммах и грязи.

Почему необходим полноценный заряд аккумулятора
- Чем чаще происходит разреженность свинцовых пластин в аккумуляторе, тем быстрее наступает процесс сульфатации.
- Качественная работа АКБ прямо пропорциональна плотности электролита.
Примечания:
- Профилактику АКБ следует проводить каждый сезон. Особенно в период осенне-зимней эксплуатации.
- АКБ приходит в негодность по разным причинам. Зачастую длительными запусками двигателя стартером. Зимой стартер потребляет повышенный ток и может привести к короблению пластин.
- Заряд аккумулятора прямо пропорционален плотности электролита степени заряда.
Как проверить плотность электролита аккумулятора
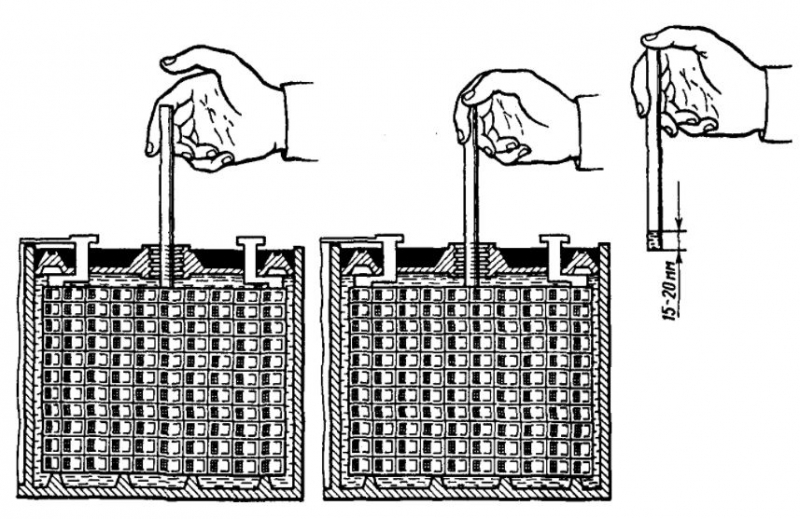
- Надеть перчатки и выкрутить все пластиковые крышки герметичных банок аккумулятора.
 Ареометр аккуратно опустить в первую банку и извлечь резиновой грушей электролит. Поплавок прибора должен находиться в свободном положении и не задевать дно и стенки банки.
Ареометр аккуратно опустить в первую банку и извлечь резиновой грушей электролит. Поплавок прибора должен находиться в свободном положении и не задевать дно и стенки банки. - Жидкость в приборе наглядно укажет показания плотности.
- Этот процесс провести поочерёдно с каждой банкой. При разнице плотности в 0,01 г-на куб. см, необходимо долить дистиллированную воду.
- При пониженной плотности до показателя 1,22 г-на куб. см и ниже необходимо поставить АКБ на зарядку.
Важно! При повышении температуры плотность электролита прямо пропорционально уменьшается на 0.01 г/см3. И, с точностью до наоборот увеличивается при понижении температуры.
Краткий инструктаж предварительной подготовки:
- Соблюдая меры безопасности подготовить необходимые ниже перечисленные инструменты и материалы.
- Самостоятельное изготовление электролита требует внимательности и аккуратности. Кислоту медленно добавляют в воду, а не наоборот.
 При добавлении в воду кислота реагирует не агрессивно, исключив ожоги и испарения. Кислота погружается в толщу воды и разбрызгивания не происходит из-за определенной реакции.
При добавлении в воду кислота реагирует не агрессивно, исключив ожоги и испарения. Кислота погружается в толщу воды и разбрызгивания не происходит из-за определенной реакции. - Ни в коем случае не переворачивайте аккумулятор! Это ведет к осыпанию пластин и может вызвать короткое замыкание.
- Специальную посуду и инструменты для приготовления электролита следует подготовить заранее:
- Защитная одежда (брезентовые рукавицы, фартук прорезиненный, кислотно-щелочестойкие перчатки, защитные очки).

- В свободном доступе бак с чистой холодной водой.
- В аптечку стоит добавить пищевую соду и нашатырный спирт.
- Различные приспособления для работы с реагентами (мензурку, резиновую грушу и воронку).
- Учесть и определенные приборы (ареометр, трубку для измерения уровня, паяльник и дрель).
- Защитная одежда (брезентовые рукавицы, фартук прорезиненный, кислотно-щелочестойкие перчатки, защитные очки).
Инструктаж по увеличению плотности электролита
Показатель плотности решает всё. Например, хорошее состояние определяет значение 1,25-1,28, и профилактика не нужна. Низкий показатель плотности (1,18-1,20) говорит о доливке электролита с плотностью 1,25.
Итак, приступаем:
- Откачиваем старый электролит резиновой грушей в одной из банок АКБ. Делаем необходимые замеры плотности.

- Новый раствор, объёмом вполовину от откачанного следует долить и медленными движениями прокачать АКБ для перемешивания.
- Измерьте плотность. Если показания неутешительны, добавьте еще часть электролита. Повторять процесс, пока не будут достигнуты нужные показатели.
Повышение плотности электролита
Наипростейшим методом решения данного вопроса — это добавление дистиллированной воды. Хотя многие не догадываются, что вода выкипает со временем, следовательно, и сам электролит тоже.
Прежде чем повышать плотность электролита, следует произвести определённые замеры. Это поможет понять износ вашего аккумулятора и выявить дальнейшие действия. Проверку следует производить правильным образом. Специальный прибор, созданный для данной процедуры — это ареометр. Электролит является небезопасным реагентом.
Прежде чем замерять его плотность, в обязательном порядке следует подумать о мерах безопасности:
- Замеры производить в специальной одежде.

- Стараться полностью избегать контакта раствора с кожей и одеждой.
- Воздержаться от курения.
Понижение плотности электролита
Обыкновенным доливом электролита вряд ли удастся решить этот вопрос. В данном варианте случае понадобится аккумуляторная кислота, потому что по плотности она выше.
Совет: если вы желаете долгую и радостную жизнь вашему аккумулятору, своевременно делайте профилактику Этот метод похож на процесс добавления электролита. Не получилось с первого раза достичь нужных результатов? Повторите процедуру до требуемого результата.
Как залить электролит в аккумулятор автомобиля, машины, инструкция видео
Хотя в настоящее время в торговле широко представлены необслуживаемые разновидности аккумуляторов, их ремонт, состоящий, прежде всего, в замене электролитической жидкости, все-таки иногда приходится производить. Это имеет большую важность для работы данных устройств, поскольку сбережение электрической энергии в них обеспечивается, благодаря химическим реакциям, нормальное прохождение которых обеспечивается именно этой жидкостью, состоящей из дистиллированной воды и серной кислоты.
Что необходимо для замены электролита в аккумуляторе?
Если на автомобиле установлена батарея старого образца, то ее зарядке в обязательном порядке должна предшествовать замена электролита. Перед проведением этой операции необходимо запастись следующими приспособлениями и материалами:
- емкостью для сбора сливаемого старого электролита;
- чистой ветошью;
- резиновой грушей с удлиненным носиком;
- зарядным устройством для автомобильных аккумуляторов;
- аэрометром, позволяющим измерять плотность жидкости;
- лейкой или воронкой для заливки электролитической жидкости в аккумуляторные банки;
- необходимым количеством готовой электролитической жидкости, которую можно самостоятельно приготовить из дистиллированной воды и серной кислоты или купить ее в магазине.
Перед заливкой в аккумулятор нового электролита из него необходимо слить находившийся в нем старый.
Каким образом производится слив старого электролита?
Чтобы слить старую электролитическую жидкость, аккумулятор необходимо снять с автомобиля и установить на устойчивую горизонтальную поверхность. Затем аккумулятор следует тщательно протереть и снять защитные крышки с его банок. Операция по сливу производится в следующем порядке:
Затем аккумулятор следует тщательно протереть и снять защитные крышки с его банок. Операция по сливу производится в следующем порядке:
- рядом с аккумуляторной батареей устанавливается емкость для сбора отработанной жидкости;
- носик подготовленной заранее резиной груши вводится в полость банки;
- груша сдавливается для удаления из нее воздуха;
- при восстановлении первоначальной формы груши происходит забор в нее жидкости из банок аккумулятора;
- жидкость из груши аккуратно сливается в стоящую рядом емкость;
- операция повторяется столько раз, сколько потребуется для полного опустошения всех банок.
При случайном попадании электролита на кожу это место следует промыть обильным количеством воды. Если попавшая жидкость сумела вызвать заметный ожог, то пораженное место необходимо обработать облепиховым маслом или аналогичным ему противоожоговым средством или же обратиться за специализированной помощью в ожоговый центр.
Заполнение аккумулятора новым электролитом
Заливке нового электролита в автомобильный аккумулятор должна предшествовать промывка последнего. Для промывки, производимой с целью очистки полости от накопившихся там загрязнений, используется дистиллированная вода. Залив ее, следует закрыть крышки и хорошо потрясти аккумулятор, чтобы обеспечить выход угольной крошки вместе со сливаемой жидкостью.
Для промывки, производимой с целью очистки полости от накопившихся там загрязнений, используется дистиллированная вода. Залив ее, следует закрыть крышки и хорошо потрясти аккумулятор, чтобы обеспечить выход угольной крошки вместе со сливаемой жидкостью.
Кроме того, очистке необходимо подвергнуть и электроды, с которых следует удалить отложившиеся на них соли.
Только лишь после завершения подготовительных манипуляций можно приступать к заливке свежего электролита, которая производится в следующем порядке:
- прежде всего, используя аэрометр, необходимо удостовериться в том, что плотность новой электролитической жидкости составляет 1,28 г/см3;
- заливка жидкости производится поочередно в каждую банку с помощью подготовленной воронки или лейки;
- при необходимости можно произвести доливку специальных присадок, которые обеспечат удаление сульфатного осадка с поверхности электродов.
Зарядка аккумулятора
К зарядке аккумулятора можно приступать после того, как:
- электролит вытеснит весь воздух, находящийся в корпусе батареи;
- произойдет полное растворение присадочных веществ.

Торопиться с началом зарядки не стоит, поскольку полное растворение присадок может продлиться до 48 часов.
Сама же зарядка производится путем чередования циклов зарядки и разрядки. Перед ее началом следует:
- снять защитные пробки;
- подсоединить клеммы зарядного устройства к аккумулятору;
- выставить ток зарядки величиной в 1 А.
Зарядку можно считать законченной, когда напряжение на каждой из банок будет равняться 2,4 В, а на клеммах аккумулятора – 14-15 В. По достижении этих величин процесс зарядки можно завершать, если плотность жидкости не изменялась в течение двух последних часов.
Как долить дистиллированную воду в аккумулятор: сколько воды должно быть
Автомобильные аккумуляторы, а также некоторые другие АКБ требуют наличия специального раствора серной кислоты для нормальной работы.
За счет неё осуществляется восстановительный процесс после разряда батареи. Периодически требуется доливать дистиллированную воду.
Периодически требуется доливать дистиллированную воду.
Можно ли добавлять воду в автомобильный аккумулятор и какую
Важно помнить – используемая жидкость представляет собой не обычную воду, а очищенную от посторонних включений. Подразумевается дистиллят. В нем должны отсутствовать соли, другие посторонние компоненты. Именно это и делает обычную воду проводником. Очищенная вода, лишенная всяких примесей, представляет собой диэлектрик.
Жидкость, присутствующая внутри АКБ, представляет собой на 65% обычную воду.
Нужно помнить: уровень электролита нужно постоянно контролировать. Если он уменьшился до определенного уровня – то требуется его в обязательном порядке долить.
Но предварительно определиться – что именно заливать: дистиллированную воду или серную кислоту (электролит).
Причин падения уровня всего две:
- корпус батареи поврежден – электролит постепенно вытекает из него,
- жидкость испаряется.

Причем второй случай требует «расследования». Так как закипание электролита служит сигналом о неисправности самого АКБ либо генератора. Только после проведения ремонта нужно осуществлять доливку. Должны применяться только специальные составы – не допускается использовать обычную воду из под крана.
Можно ли залить электролит
Электролит представляет собой специальный состав, включающий воду и серную кислоту в следующем соотношении:
- серная кислота – 35%,
- дистиллированная вода – 65%.
Стандартная плотность, позволяющая протекать всем реакциям внутри АКБ в нормальном режиме, составляет 1.27 г/см3. Нужно помнить – не допускается добавлять в состав кислоты более, чем 35%. Так как это сказывается на скорости заряда, а также остальных качествах.
Например, при плотности электролита 1.4 г/см3 может стать причиной серьезных неприятностей – пластины будут повреждаться и постепенно осыпаться. Но меньшее количество кислоты также заливать не рекомендуется. Так как жидкость внутри АКБ просто замерзнет при отрицательной температуре. Нужно отметить: требуемая плотность является эталонной. Занижать и завышать её не рекомендуется.
Так как жидкость внутри АКБ просто замерзнет при отрицательной температуре. Нужно отметить: требуемая плотность является эталонной. Занижать и завышать её не рекомендуется.
Доливать нужно правильно: при закипании в процессе химических реакций из АКБ уходит именно вода. При этом количество серной кислоты в массовом отношении остается прежним. Чтобы сохранить соотношение 35%/65% необходимо заливать именно дистиллированную воду приобретенную в специальных магазинах. Использовать для этих целей обычную, кипяченую не следует – аккумулятор просто выйдет из строя в результате короткого замыкания банок.
Процесс добавления жидкости в банки – технически не сложный, но требующий внимательности и осторожности. Серная кислота представляет собой серьезную угрозу для жизни, здоровья человека. Желательно избегать утечки. Она может привести к серьезным неприятностям – ожогам. Доливать следует в хорошо проветриваемом помещении.
Когда нужно добавлять воду и сколько
Важно постоянно следить за уровнем электролита в банках: причем опасен не только высокий, но и низкий. Корпус АКБ обычно снабжается специальным уровнем – электролит обязательно должен отличаться в большую или меньшую сторону на 1-2 мм. Соответственно при пониженном уровне существенно вырастет плотность – что приводит к постепенной сульфатации пластин. В долгосрочной перспективе это приводит к их полному разрушению.
Корпус АКБ обычно снабжается специальным уровнем – электролит обязательно должен отличаться в большую или меньшую сторону на 1-2 мм. Соответственно при пониженном уровне существенно вырастет плотность – что приводит к постепенной сульфатации пластин. В долгосрочной перспективе это приводит к их полному разрушению.
При повышенном уровне плотность электролита уменьшается. Как следствие – жидкость просто может замерзнуть при отрицательных температурах. Следствием замерзания становится отвердевание состава и поломка пластикового корпуса изнутри. Нужно помнить: опасность такой ситуации заключается в том, что летом обычно проблем с этим не возникает. Но зимой дистиллят будет схватываться уже при -20/-300С.
Потому если вы обнаружили полупустые банки в АКБ – нужно срочно долить дистиллированную воду. Обычную использовать противопоказано. Её наличие приведет к короткому замыканию.
Как правильно заливать воду
Процесс заливки сравнительно просто и не требует специального оборудования.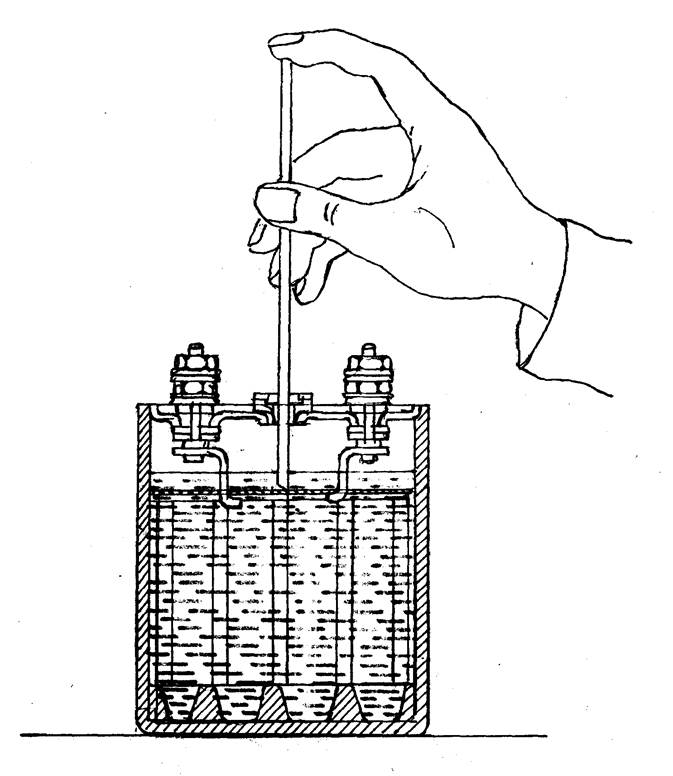 Понадобится подготовить следующее:
Понадобится подготовить следующее:
- перчатки – устойчивые в разрушительному воздействию серной кислоты,
- специальная воронка – она позволяет не разлить жидкость при доливке,
- очки для защиты глаз – попадание серной кислоты на слизистую оболочку может стать причиной серьезных неприятностей.
Когда все готово – можно приступать непосредственно к доливке:
- откручиваем пробки,
- вставляет воронку,
- аккуратно, до определенного уровня доливаем дистиллированную воду.
Нужно помнить: если жидкости больше, чем нужно – следует её извлечь при помощи специальной груши. Приобрести её можно в любом автомобильном магазине. Основное условие – материал обязательно должен быть устойчив к кислотной среде.
Как залить воду в необслуживаемый аккумулятор
Обычно в необслуживаемый аккумулятор не требуется доливать жидкость. При изготовлении используется кальциевая технология – потери воды минимальны. Но уже через 5 лет добавить дестилят будет необходимо. Процесс доливки жидкости в необслуживаемый АКБ:
Но уже через 5 лет добавить дестилят будет необходимо. Процесс доливки жидкости в необслуживаемый АКБ:
- нужно определить уровень электролита – для этого достаточно качнуть батарею из стороны в сторону,
- выясняем, на какой высоте находятся пластины – сделать это можно с помощью фонарика (достаточно просветить корпус),
- нужно отступить вверх от пластин примерно 2 см – после чего сверлится отверстие диаметром 8 мм,
- при помощи обычного шприца и иголки добавляется жидкость.
Процесс заливки жидкости внутрь корпуса аккумуляторной батареи не представляет собой серьезных проблем. Важно лишь соблюдать уровень.
Что такое аккумулятор? — learn.sparkfun.com
Добавлено в избранное Любимый 20Введение
Батареи — это совокупность одной или нескольких ячеек, химические реакции которых создают поток электронов в цепи.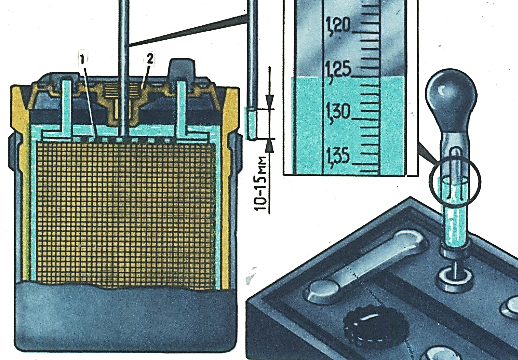 Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и какого-то электролита (вещество, которое химически реагирует с анодом и катодом).
Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и какого-то электролита (вещество, которое химически реагирует с анодом и катодом).
Когда анод и катод батареи подключены к цепи, между анодом и электролитом происходит химическая реакция. Эта реакция заставляет электроны проходить через цепь и возвращаться на катод, где происходит другая химическая реакция. Когда материал в катоде или аноде расходуется или больше не может использоваться в реакции, батарея не может производить электричество. В этот момент ваша батарея «разряжена».
Батареи, которые необходимо выбрасывать после использования, известны как первичные батареи .Аккумуляторы, которые можно перезаряжать, называются вторичными батареями и .
Литий-полимерные батареи, например, можно заряжать
Без батарей ваш квадрокоптер пришлось бы привязать к стене, вам пришлось бы вручную провернуть машину, а ваш контроллер Xbox должен был бы быть постоянно подключен к сети (как в старые добрые времена).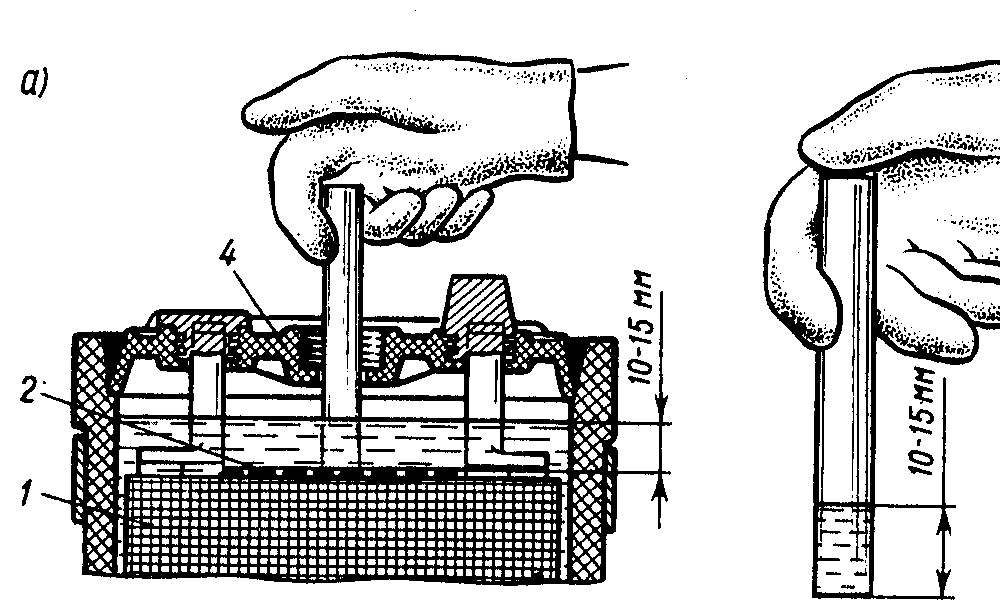 Батареи позволяют хранить потенциальную электрическую энергию в переносном контейнере.
Батареи позволяют хранить потенциальную электрическую энергию в переносном контейнере.
Батареи бывают разных форм, размеров и химического состава.
Изобретение современной батареи часто приписывают Алессандро Вольта. На самом деле все началось с удивительной аварии, связанной с рассечением лягушки.
Что вы узнаете
В этом руководстве будут подробно рассмотрены следующие темы:
- Как были изобретены батарейки
- Из каких частей состоит аккумулятор
- Как работает аккумулятор
- Общие термины, используемые для описания батарей
- Различные способы использования батарей в схемах
Рекомендуемая литература
Есть несколько концепций, с которыми вы, возможно, захотите ознакомиться перед тем, как начать читать это руководство:
Хотите изучить различные батареи?
Мы вас прикрыли!
Щелочная батарея 9 В
В наличии PRT-10218 Это ваши стандартные щелочные батарейки на 9 вольт от Rayovac. Даже не думайте пытаться перезарядить их. Используйте их с…
Даже не думайте пытаться перезарядить их. Используйте их с…
История
Термин Батарея
Исторически слово «батарея» использовалось для описания «серии подобных объектов, сгруппированных вместе для выполнения определенной функции», как в случае артиллерийской батареи. В 1749 году Бенджамин Франклин впервые использовал этот термин для описания серии конденсаторов, которые он соединил вместе для своих экспериментов с электричеством.Позже этот термин будет использоваться для любых электрохимических ячеек, соединенных вместе с целью обеспечения электроэнергии.
Батарея «конденсаторов» Лейденской банки, соединенная вместе(Изображение любезно предоставлено Альвинруном из Wikimedia Commons)
Изобретение батареи
В один роковой день 1780 года итальянский физик, врач, биолог и философ Луиджи Гальвани рассекал лягушку, прикрепленную к медному крючку. Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Вольта выдвинул гипотезу, что импульсы лягушки на лапах на самом деле были вызваны различными металлами, пропитанными жидкостью. Он повторил эксперимент, используя ткань, пропитанную рассолом, вместо трупа лягушки, что привело к аналогичному напряжению. Вольта опубликовал свои открытия в 1791 году, а позже создал первую батарею, гальваническую батарею, в 1800 году.
Гальваническая свая состояла из пакета цинковых и медных пластин, разделенных тканью, пропитанной рассолом
СтопкаVolta страдала от двух основных проблем: из-за ее веса электролит вытек из ткани, а особые химические свойства компонентов привели к очень короткому сроку службы (около часа).Следующие двести лет уйдут на совершенствование конструкции Вольты и решение этих проблем.
Исправления к гальванической свае
Уильям Крукшанк из Шотландии решил проблему утечки, положив гальваническую батарею на бок, чтобы сформировать «желобную батарею».
Лотковая батарея решила проблему утечки гальванической сваи
Вторая проблема, короткий срок службы, была вызвана разложением цинка из-за примесей и скоплением пузырьков водорода на меди.В 1835 году Уильям Стерджен обнаружил, что обработка цинка ртутью предотвратит разложение.
Британский химик Джон Фредерик Даниэлл использовал второй электролит, который вступал в реакцию с водородом, предотвращая накопление на медном катоде. Батарея Даниэля с двумя электролитами, известная как «элемент Даниэля», станет очень популярным решением для обеспечения энергией зарождающихся телеграфных сетей.
Коллекция клеток Даниэля из 1836 г.
Первая аккумуляторная батарея
В 1859 году французский физик Гастон Планте создал батарею из двух прокатанных листов свинца, погруженных в серную кислоту.Путем изменения направления электрического тока через батарею химический состав вернется в исходное состояние, создав первую перезаряжаемую батарею.
Позже, в 1881 году, Камилла Альфонс Фор улучшила конструкцию Планте, превратив листы свинца в пластины. Эта новая конструкция упростила производство аккумуляторов, а свинцово-кислотные аккумуляторы получили широкое распространение в автомобилях.
-> Дизайн обычного «автомобильного аккумулятора» существует уже более 100 лет
(Изображение любезно предоставлено Эмилианом Робертом Виколом из Wikimedia Commons) <-
Сухая камера
Вплоть до конца 1800-х годов электролит в батареях был в жидком состоянии.Это сделало транспортировку аккумуляторов очень осторожным делом, и большинство аккумуляторов никогда не предназначалось для перемещения после подключения к цепи.
В 1866 году Жорж Лекланше создал батарею, используя цинковый анод, катод из диоксида марганца и раствор хлорида аммония в качестве электролита. Хотя электролит в элементе Лекланше все еще был жидкостью, химический состав батареи оказался важным шагом для изобретения сухого элемента.
Карл Гасснер придумал, как создать электролитную пасту из хлорида аммония и гипса.Он запатентовал новую «сухую» батарею в 1886 году в Германии.
Эти новые сухие элементы, обычно называемые «угольно-цинковыми батареями», производились массово и пользовались огромной популярностью до конца 1950-х годов. Хотя углерод не используется в химической реакции, он играет важную роль в качестве электрического проводника в углеродно-цинковой батарее.
-> Цинк-угольная батарея 3 В 1960-х годов
(Изображение любезно предоставлено PhFabre из Wikimedia Commons) <-
В 1950-х годах Льюис Урри, Пол Марсал и Карл Кордеш из компании Union Carbide (позже известной как «Eveready», а затем «Energizer») заменили электролит хлористого аммония щелочным веществом на основе химического состава батареи, сформулированного Вальдемаром. Юнгнер в 1899 году.Щелочные батареи с сухими элементами могут содержать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
Щелочные батареи приобрели популярность в 1960-х годах, обогнали угольно-цинковые батареи и с тех пор стали стандартными первичными элементами для потребительского использования.
-> Щелочные батареи бывают разных форм и размеров
(Изображение любезно предоставлено Aney ~ commonswiki из Wikimedia Commons) <-
Аккумуляторы 20-го века
В 1970-х годах компания COMSAT разработала никель-водородную батарею для использования в спутниках связи.Эти батареи хранят водород в газообразной форме под давлением. Многие искусственные спутники, такие как Международная космическая станция, по-прежнему используют никель-водородные батареи.
Исследования нескольких компаний с конца 1960-х годов привели к созданию никель-металлгидридной (NiMH) батареи. NiMH батареи были выпущены на потребительский рынок в 1989 году и стали более дешевой альтернативой никель-водородным аккумуляторным элементам меньшего размера.
Компания Asahi Chemical из Японии построила первую литий-ионную батарею в 1985 году, а Sony создала первую коммерческую литий-ионную батарею в 1991 году.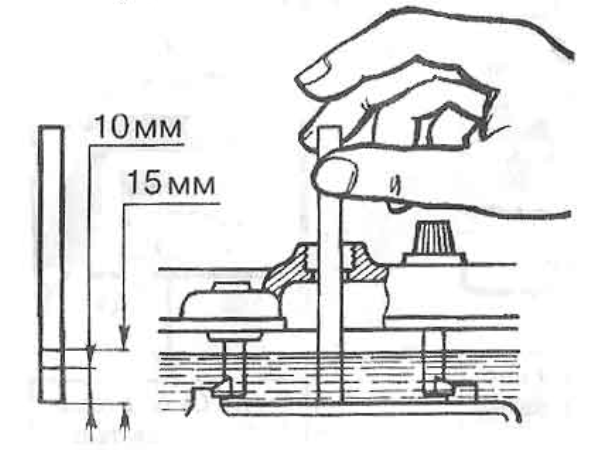 В конце 1990-х годов был создан мягкий гибкий корпус для литий-ионных аккумуляторов, в результате чего возникли «литий-полимерные» или «LiPo» аккумуляторы.
В конце 1990-х годов был создан мягкий гибкий корпус для литий-ионных аккумуляторов, в результате чего возникли «литий-полимерные» или «LiPo» аккумуляторы.
Химические реакции в литий-полимерной батарее практически такие же, как и в литий-ионной батарее
Очевидно, что было изобретено, произведено и устарело гораздо больше химикатов батарей. Если вы хотите узнать больше о современных и популярных технологиях аккумуляторов, ознакомьтесь с нашим руководством по технологиям аккумуляторов.
Компоненты
Батареисостоят из трех основных компонентов: анода , катода и электролита . Сепаратор часто используется для предотвращения соприкосновения анода и катода, если электролита недостаточно. Для хранения этих компонентов аккумуляторы обычно имеют какой-то кожух .
Хорошо, большинство батарей на самом деле не разделены на три равные части, но вы поняли. Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.
Лучшее поперечное сечение щелочной ячейки можно найти в Википедии. И анод, и катод относятся к типу электродов . Электроды — это проводники, через которые электричество входит или выходит из компонента в цепи.
Анод
Электроны выходят из анода в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет в анод.
На аккумуляторах анод отмечен как отрицательная (-) клемма
В батарее химическая реакция между анодом и электролитом вызывает накопление электронов на аноде.Эти электроны хотят двигаться к катоду, но не могут пройти через электролит или сепаратор.
Катод
Электроны текут в катод в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет из катода.
На аккумуляторах катод помечен как положительный (+) вывод
В батареях в химической реакции внутри катода или вокруг него используются электроны, образующиеся на аноде. Электроны могут попасть на катод только через цепь, внешнюю по отношению к батарее.
Электроны могут попасть на катод только через цепь, внешнюю по отношению к батарее.
Электролит
Электролит — это вещество, часто жидкость или гель, способное переносить ионы между химическими реакциями, происходящими на аноде и катоде. Электролит также препятствует потоку электронов между анодом и катодом, так что электроны легче проходят через внешнюю цепь, чем через электролит.
-> В щелочных батареях может протекать электролит, гидроксид калия, если они подвергаются воздействию высоких температур или обратного напряжения.
(Изображение любезно предоставлено Вильямом Дэвисом из Wikimedia Commons) <-
Электролит имеет решающее значение в работе аккумулятора.Поскольку электроны не могут проходить через него, они вынуждены проходить через электрические проводники в виде цепи, соединяющей анод с катодом.
Сепаратор
Сепараторы представляют собой пористые материалы, которые предотвращают соприкосновение анода и катода, что может вызвать короткое замыкание в батарее. Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы не вступают в химическую реакцию ни с анодом, ни с катодом, ни с электролитом.
Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы не вступают в химическую реакцию ни с анодом, ни с катодом, ни с электролитом.
В гальванической куче использовалась ткань или картон (разделитель), пропитанные рассолом (электролитом), чтобы электроды разнесены.
Ионы в электролите могут быть положительно заряженными, отрицательно заряженными и иметь различные размеры. Могут быть изготовлены специальные сепараторы, которые пропускают одни ионы, но не пропускают другие.
Кожух
Большинству батарей требуется способ удерживать химические компоненты. Кожухи, также известные как «кожухи» или «оболочки», представляют собой просто механические конструкции, предназначенные для удержания внутренних компонентов батареи.
Свинцово-кислотный аккумулятор в пластиковом корпусе
Корпуса аккумуляторов могут быть изготовлены практически из чего угодно: из пластика, стали, мягких пакетов из полимерного ламината и так далее. В некоторых батареях используется токопроводящий стальной кожух, который электрически соединен с одним из электродов. В случае обычного щелочного элемента AA стальной кожух соединен с катодом.
В некоторых батареях используется токопроводящий стальной кожух, который электрически соединен с одним из электродов. В случае обычного щелочного элемента AA стальной кожух соединен с катодом.
Операция
Батареи обычно требуют нескольких химических реакций для работы.По крайней мере, одна реакция происходит внутри анода или вокруг него, и одна или несколько реакций происходят внутри или вокруг катода. Во всех случаях реакция на аноде дает дополнительные электроны в процессе, называемом окислением , а реакция на катоде использует дополнительные электроны во время процесса, известного как восстановление .
Когда переключатель замкнут, цепь замыкается, и электроны могут течь от анода к катоду. Эти электроны активируют химические реакции на аноде и катоде.
По сути, мы разделяем определенный вид химической реакции, реакцию восстановления-окисления или окислительно-восстановительную реакцию, на две отдельные части. При переносе электронов между химическими веществами происходят окислительно-восстановительные реакции. В этой реакции мы можем использовать движение электронов, чтобы они выходили за пределы батареи и питали нашу цепь.
При переносе электронов между химическими веществами происходят окислительно-восстановительные реакции. В этой реакции мы можем использовать движение электронов, чтобы они выходили за пределы батареи и питали нашу цепь.
Анодное окисление
Эта первая часть окислительно-восстановительной реакции, окисление, происходит между анодом и электролитом и производит электроны (обозначены как e — ).
Некоторые реакции окисления образуют ионы, например, в литий-ионной батарее. В других химических реакциях расходуются ионы, как в обычных щелочных батареях. В любом случае ионы могут свободно проходить через электролит, а электроны — нет.
Катодное восстановление
Другая половина окислительно-восстановительной реакции, восстановление, происходит в катоде или рядом с ним. Электроны, образующиеся в результате реакции окисления, расходуются во время восстановления.
В некоторых случаях, например, в литий-ионных батареях, положительно заряженные ионы лития, образующиеся во время реакции окисления, расходуются во время восстановления.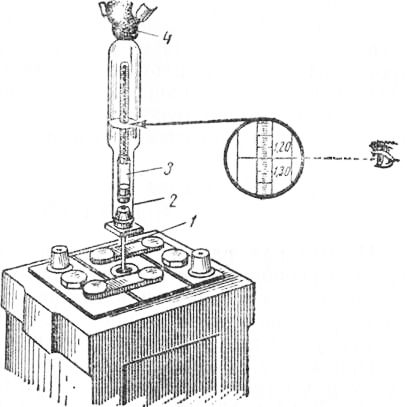 В других случаях, например, в щелочных батареях, во время восстановления образуются отрицательно заряженные ионы.
В других случаях, например, в щелочных батареях, во время восстановления образуются отрицательно заряженные ионы.
Электронный поток
В большинстве батарей некоторые или все химические реакции могут происходить, даже когда батарея не подключена к цепи. Эти реакции могут повлиять на срок годности батареи.
По большей части, реакции будут происходить с полной силой только тогда, когда между анодом и катодом замыкается электрически проводящая цепь. Чем меньше сопротивление между анодом и катодом, тем больше электронов может течь и тем быстрее протекают химические реакции.
Короткое замыкание в аккумуляторе (в данном случае даже случайное) может быть опасным. Известно, что литий-ионные батареи перегреваются и даже задымляются или загораются при коротком замыкании.
Мы можем пропускать эти движущиеся электроны через различные электрические компоненты, известные как «нагрузка», для выполнения чего-то полезного. В анимационном ролике в начале этого раздела мы зажигаем виртуальную лампочку движущимися электронами.
Батарея разряжена
Химические вещества в аккумуляторе в конечном итоге достигают состояния равновесия. В этом состоянии химические вещества больше не будут реагировать, и в результате аккумулятор больше не будет генерировать электрический ток. На данный момент аккумулятор считается «мертвым».
Первичные элементы необходимо утилизировать, когда батарея разряжена. Вторичные элементы можно перезаряжать, и это достигается путем пропускания через батарею обратного электрического тока.Перезарядка происходит, когда химические вещества выполняют еще одну серию реакций, чтобы вернуть их в исходное состояние.
Терминология
Люди часто используют общий набор терминов, говоря о напряжении аккумулятора, емкости, возможности источника тока и так далее.
Ячейка
Элемент относится к одному аноду и катоду, разделенным электролитом, используемым для выработки напряжения и тока. Батарея может состоять из одной или нескольких ячеек.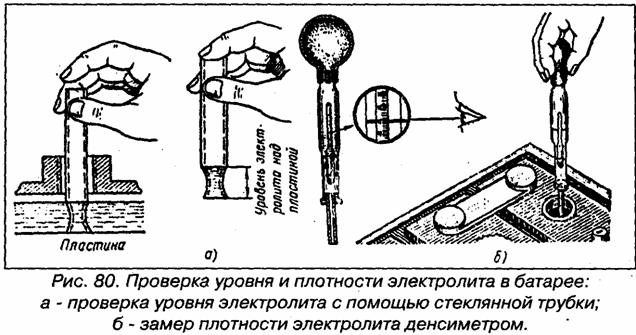 Например, одна батарея AA — это одна ячейка. Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В.
Например, одна батарея AA — это одна ячейка. Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В.
Обычная 9-вольтовая батарея содержит шесть щелочных элементов по 1,5 В, установленных друг на друга
Первичный
Первичные клетки содержат химический состав, который нельзя изменить. В результате аккумулятор необходимо выбрасывать после того, как он разрядился.
Среднее
Вторичные элементы можно перезаряжать, и их химический состав возвращается в исходное состояние.Эти элементы, иначе известные как «аккумуляторные батареи», можно использовать много раз.
Номинальное напряжение
Номинальное напряжение аккумулятора — это напряжение, указанное производителем.
Например, щелочные батареи типа AA указаны как имеющие 1,5 В. В этой статье Mad Scientist Hut показано, что их испытанные щелочные батареи начинаются с напряжения примерно 1,55 В, а затем медленно теряют напряжение по мере разряда. В этом примере номинальное напряжение «1,5 В» относится к максимальному или пусковому напряжению батареи.
Этот аккумуляторный блок Storm для квадрокоптеров показывает кривую разряда для их LiPo-элементов, начиная с 4,2 В и снижаясь до 2,8 В по мере разряда. Номинальное напряжение, указанное для большинства литий-ионных и LiPo-элементов, составляет 3,7 В. В этом случае номинальное напряжение «3,7 В» относится к среднему напряжению аккумулятора в течение всего цикла разряда.
Вместимость
Емкость аккумулятора — это мера количества электрического заряда, который он может доставить при определенном напряжении. Большинство батарей рассчитаны на ампер-часы (Ач) или миллиампер-часы (мАч).
Этот LiPo аккумулятор рассчитан на 1000 мАч, что означает, что он может обеспечить 1 ампер в течение 1 часа, прежде чем он будет считаться разряженным.
Большинство графиков разряда батареи показывает напряжение батареи как функцию от емкости, например, эти тесты батареи AA, проведенные PowerStream. Чтобы выяснить, достаточно ли емкости аккумулятора для питания вашей схемы, найдите самое низкое допустимое напряжение и найдите соответствующий номинал мАч или Ач.
C-скорость
Многие батареи, особенно мощные литий-ионные, обозначают ток разряда как «C-Rate», чтобы более четко определить характеристики батареи.C-Rate — это скорость разряда относительно максимальной емкости аккумулятора.
1С — это количество тока, необходимое для разрядки аккумулятора за 1 час. Например, аккумулятор емкостью 400 мАч, обеспечивающий ток 1С, будет обеспечивать 400 мА. 5С для той же батареи будет 2 А.
Большинство батарей теряют емкость при повышенном потреблении тока. Например, этот информационный график продукта от Chargery показывает, что их LiPo-элемент имеет меньше мАч при более высоких скоростях C.
ПРИМЕЧАНИЕ: Общий совет гласит, что вы должны заряжать LiPo батареи при 1С или ниже.
MIT предлагает фантастическое руководство по спецификациям и терминологии батарей, которое идет намного дальше этого обзора.
Использование
Однокамерный
Некоторые схемы могут питаться от одного элемента, но убедитесь, что батарея может обеспечивать достаточное напряжение и ток.
Если напряжение слишком высокое или слишком низкое для вашей схемы, вам, вероятно, понадобится преобразователь постоянного тока в постоянный.
серии
Чтобы увеличить напряжение между выводами батареи, вы можете расположить элементы последовательно. Последовательность означает штабелирование ячеек встык, соединение анода одного с катодом следующего.
Последовательно соединяя батареи, вы увеличиваете общее напряжение. Сложите напряжение всех ячеек, чтобы определить рабочее напряжение. Емкость остается прежней.
В этом примере четыре ячейки 1,5 В соединены последовательно.Напряжение на нагрузке составляет 6 В, а общий набор аккумуляторов имеет емкость 2000 мАч.
В большинстве бытовых электронных устройств, в которых используются щелочные батареи, батареи устанавливаются последовательно. Например, этот держатель батареек 2x AA может поднять номинальное напряжение до 3 В для проекта.
Параллельно
Если напряжение отдельного элемента соответствует нагрузке, вы можете добавить батареи параллельно, чтобы увеличить емкость. Обратите внимание, что это также означает увеличение доступного тока (C-Rate).
Будьте осторожны при параллельном подключении аккумуляторов! Все элементы должны иметь одинаковое номинальное напряжение и одинаковый уровень заряда. Если есть какие-либо различия в напряжении, может произойти короткое замыкание, что приведет к перегреву и, возможно, возгоранию.
В этом примере четыре ячейки 1,5 В подключены параллельно. Напряжение на нагрузке остается на уровне 1,5 В, но общая емкость увеличивается до 8000 мАч.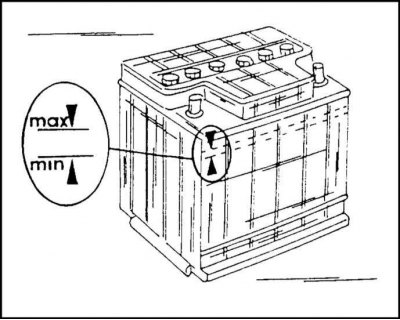
и параллельный
Если вы хотите увеличить напряжение и емкость, вы можете комбинировать последовательные и параллельные батареи. Еще раз убедитесь, что уровень напряжения одинаков для батарей, включенных параллельно, так как может произойти короткое замыкание.
В этом примере полное напряжение на нагрузке составляет 3 В, а общая емкость аккумуляторов составляет 4000 мАч.
В больших аккумуляторных блоках, особенно литий-ионных, вы часто видите конфигурацию, указанную с использованием «S» и «P» для последовательного и параллельного подключения. Конфигурация схемы выше — 2S2P. В качестве практического примера современные электромобили используют массивные массивы батарей, соединенных последовательно и параллельно.
Ресурсы и дальнейшее развитие
К настоящему времени вы должны понимать, как были изобретены батарейки и как они работают. Батареи — это один из способов обеспечения вашего проекта электроэнергией, и они могут быть невероятно полезны, если вам нужен портативный источник питания.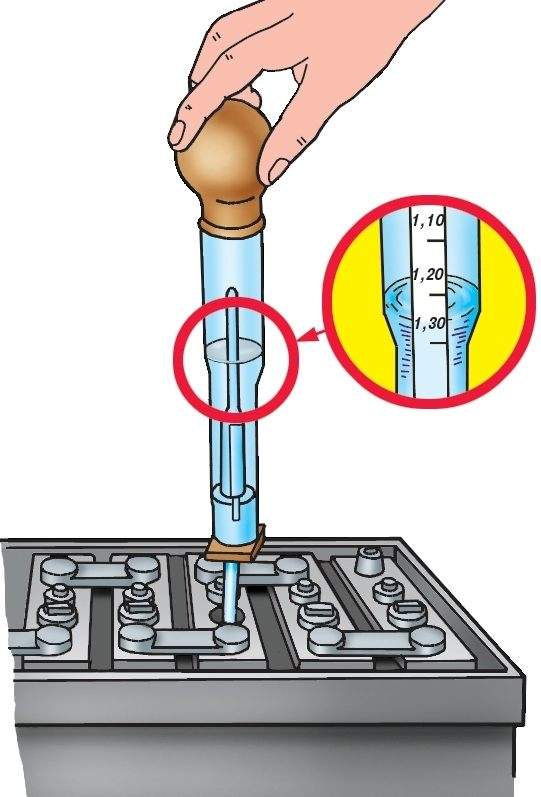
Если вы хотите больше узнать о батареях, вот еще несколько уроков:
Хотите увидеть аккумуляторы в действии? Взгляните на эти проекты, в которых используются разные батареи в разных конфигурациях:
Simon Splosion Wireless
Это учебное пособие, демонстрирующее один из многих методов «взлома» Саймона Сэйса. Мы выделим технику, чтобы взять ваш Simon Says Wireless.
Новые многоразовые батареи могут стать толчком к революции электромобилей
Электромобили менее вредны для окружающей среды, чем их бензиновые аналоги, но их длительное время зарядки и нехватка зарядных станций могут усложнить жизнь экологичным автомобилистам, которые водят их .
Теперь помощь может быть на горизонте. Ученые работают над разработкой многоразовых или так называемых проточных батарей, которые можно заправить за считанные минуты на обширной сети переделанных заправочных станций. Это изменение может сделать электромобили (EV) более привлекательными для водителей, которые опасаются длительного времени зарядки.
Это изменение может сделать электромобили (EV) более привлекательными для водителей, которые опасаются длительного времени зарядки.
«Вы проезжаете 300 миль, сливаете свой бак, заправляете новую [жидкость] — столько, сколько нужно, чтобы заправить вашу машину бензином — и уезжаете», — говорит Джон Кушман, профессор наук о Земле и атмосфере, а также математики. в Purdue и ведущим исследователем технологии жидких батарей.
Ли Кронин, химик из Университета Глазго в Шотландии и другой ведущий исследователь этой технологии, согласен с этим. По его словам, проточные батареи «превратят электромобили в культурный эквивалент топливного автомобиля. Ваше беспокойство по поводу диапазона исчезнет. И у вас есть существующая трубопроводная инфраструктура для перемещения жидкостей »- это ссылка на существующие в настоящее время заправочные станции, которые можно было бы модернизировать для перекачивания жидкости из аккумулятора вместо бензина.
Поворот в перезарядке
Подобно литий-ионным батареям, которыми сегодня питается большинство электромобилей, проточные батареи выделяют энергию за счет химических реакций между концами батареи и веществом, известным как электролит. В литий-ионной батарее электролит находится между концами батареи; когда он истощается, его нужно подзарядить. В проточной батарее электролит перекачивается из бака через батарею; когда он закончится, его можно просто заменить на новую партию.
В литий-ионной батарее электролит находится между концами батареи; когда он истощается, его нужно подзарядить. В проточной батарее электролит перекачивается из бака через батарею; когда он закончится, его можно просто заменить на новую партию.
Связанные
Современные проточные батареи используются с 1980-х годов. Их долгий срок службы и легкая подзарядка означают, что они хорошо подходят для крупномасштабного хранения энергии. Но они всегда были слишком большими и слишком тяжелыми для использования в транспортных средствах, — говорит Уильям Чуэ, ученый из Стэнфорда, имеющий опыт в области аккумуляторных технологий.
Кушман и Кронин работают над решением этой проблемы, хотя их команды используют совершенно разные подходы.
Команда Кронина работает над увеличением плотности энергии проточных батарей путем создания электролита с высокой концентрацией оксида металла. Команда Кушмана объявила 7 февраля, что они создали жидкую батарею с плотностью энергии в три-пять раз выше обычной путем прокачки электролита через несколько аккумуляторных ячеек на высокой скорости.
Результат тот же: и Кушман, который в 2016 году основал стартап IFBattery, и Кронин говорят, что их навороченные проточные батареи могут быть небольшими и достаточно легкими для использования в электромобилях.Оба также говорят, что электролит может быть переработан в процессе, который Кушман сравнивает с переработкой банок.
Препятствия, которые необходимо преодолеть
Но если двое ученых возлагают большие надежды на свои аккумуляторные технологии, другие эксперты проявляют осторожность.
Хайлианг Ван, профессор химии в Йельском университете и эксперт по хранению энергии, называет новую технологию возможным «переломным моментом», но говорит, что существуют большие препятствия, которые необходимо преодолеть, включая стоимость и надежность. А Гил Тал, директор Исследовательского центра гибридных и электромобилей при Калифорнийском университете в Дэвисе, говорит, что за десять лет работы с электромобилями он видел много заявлений, подобных заявлению Кушмана и Кронина, и они редко оправдываются. «Между стоимостью, надежностью и безопасностью, — говорит он, — большинство из этих вещей никогда не дойдет до автомобилей».
«Между стоимостью, надежностью и безопасностью, — говорит он, — большинство из этих вещей никогда не дойдет до автомобилей».
Скотт Грин, защитник электромобилей в районе метро Чикаго, говорит, что автомобилистам может быть сложно заменить электролит проточных батарей самостоятельно. Это лишит его того, что, по его словам, является одним из самых привлекательных качеств электромобилей: возможность легко заряжать их дома.
«Если это означает возврат к типичной парадигме поставщика топлива и технического обслуживания, то это будет сложнее продать, чем традиционные электромобили« подключить дома », — сказал он.
Выход на рынок
Несмотря ни на что, неясно, когда на рынке появятся транспортные средства с питанием от потоковых батарей. Кушман говорит, что надеется испытать эту технологию на автомобилях в ближайшие три года. Кронин рассчитывает потратить до 18 месяцев на тестирование электролита, разработанного его командой.
Швейцарская компания NanoFlowcell представила то, что она назвала спортивным автомобилем с питанием от аккумуляторной батареи, в 2014 году, но автомобиль еще не запущен в производство. В июне компания объявила, что на строительство завода, на котором будут выпускать автомобили, потребуется около двух лет.
В июне компания объявила, что на строительство завода, на котором будут выпускать автомобили, потребуется около двух лет.
Кронин и Кушман согласны с тем, что все зависит от того, смогут ли исследовательские группы получить деньги и партнерские отношения, необходимые для масштабного производства поточных автомобилей с батарейным питанием. И даже с их преимуществами неясно, насколько хорошо проточные батареи будут конкурировать с литий-ионными батареями, которые доминировали на рынке в течение многих лет.
Кушман признает неопределенность, даже несмотря на то, что его стартап начинает партнерство с, по его словам, «крупным игроком» в автомобильном бизнесе. «Сработает ли это, покажет время», — говорит он.«Но это наша цель».
Хотите больше историй о технологиях?
ПОДПИСАТЬСЯ НА NBC NEWS MACH В TWITTER, FACEBOOK И INSTAGRAM.
Как работает аккумулятор и 3 способа его испортить
Одно из самых полезных электронных устройств, доступных нам, также является одним из самых распространенных. Современные батареи используются во многих из наших любимых технологий, что можно почти простить за то, что вы не тратите время на изучение их работы.
Современные батареи используются во многих из наших любимых технологий, что можно почти простить за то, что вы не тратите время на изучение их работы.
Но теперь для вас настало время расширить свою базу знаний за счет понимания того, как работает смартфон в вашем кармане, каковы распространенные разновидности аккумуляторов и что вы можете сделать, чтобы продлить срок их службы.
Краткая история батарей
Алессандро Вольта продемонстрировал первую работающую электромагнитную батарею в 1800 году.Его стопка медных и цинковых пластин, разделенных пропитанными рассолом бумажными дисками, вырабатывала стабильное напряжение в течение «разумного» периода времени. Это было известно как гальваническая батарея и стало предшественником поколения экспериментов с батарейным питанием.
Это было известно как гальваническая батарея и стало предшественником поколения экспериментов с батарейным питанием.
В 1836 году Джон Фредерик Дэниелл стандартизировал конструкцию батареи. Медный горшок, наполненный раствором медного купороса, погруженный в неглазурованный глиняный сосуд, наполненный серной кислотой, и цинковый электрод стали де-факто стандартом аккумуляторов, распространенным в бесчисленных электрических телеграфных сетях.
Медный горшок, наполненный раствором медного купороса, погруженный в неглазурованный глиняный сосуд, наполненный серной кислотой, и цинковый электрод стали де-факто стандартом аккумуляторов, распространенным в бесчисленных электрических телеграфных сетях.
Перенесемся в Оксфордский университет, 1979 год. Джон Гуденаф и Коичи Мидзусима продемонстрировали работающий перезаряжаемый элемент с диапазоном 4 В, в котором оксид лития-кобальта использовался в качестве положительного электрода и металлического лития в качестве отрицательного. Предшественник литиевого элемента в том виде, в каком мы его знаем, родился — но был коммерциализирован только в 1991 году Sony и Asahi Kasei в своих портативных электронных устройствах.
Джон Гуденаф и Коичи Мидзусима продемонстрировали работающий перезаряжаемый элемент с диапазоном 4 В, в котором оксид лития-кобальта использовался в качестве положительного электрода и металлического лития в качестве отрицательного. Предшественник литиевого элемента в том виде, в каком мы его знаем, родился — но был коммерциализирован только в 1991 году Sony и Asahi Kasei в своих портативных электронных устройствах.
Что такое современный аккумулятор?
Мы используем термин современная батарея для описания электрохимических элементов, которые питают наши портативные технологические устройства. Батареи делятся на две общие категории:
Батареи делятся на две общие категории:
- Одноразовые: одноразовые батареи с электродами, которые необратимо меняются во время использования.
- Аккумуляторные: многоразовые батареи с электродами, восстанавливаемыми обратным током.
В большинстве современных портативных электронных устройств используется литиевая батарея, наиболее распространенной из которых является литий-ионный ( Li-ion ) элемент. Вы также можете встретить литий-полимерный ( Li-Po ) элемент, который имеет такой же электрохимический состав и общий химический состав, что и его аналог, но стоит дороже в производстве и имеет более низкую плотность энергии.
Вы также можете встретить литий-полимерный ( Li-Po ) элемент, который имеет такой же электрохимический состав и общий химический состав, что и его аналог, но стоит дороже в производстве и имеет более низкую плотность энергии.
Тем не менее, Li-Po аккумуляторы по-прежнему популярны из-за их легкого веса, гибкости конструкции и улучшенных рабочих характеристик при более высоких и низких температурах, с чем Li-ion может бороться.
Литий-ионные батареи обычно содержат интеркалированное соединение лития, такое как оксид лития-кобальта (LiCoO 2 ) в качестве одного электрода, графит в качестве второго и органический растворитель в качестве электролита. Это соединение используется из-за его высокой плотности энергии и медленной потери заряда, когда он не используется, а также из-за того, что не требуется циклическое переключение памяти для продления срока службы батареи.
Это соединение используется из-за его высокой плотности энергии и медленной потери заряда, когда он не используется, а также из-за того, что не требуется циклическое переключение памяти для продления срока службы батареи.
Все литиевые батареи содержат температурный коэффициент давления. Это отказоустойчивый переключатель или датчик, предназначенный для предотвращения перегрева батареи в экстремальных условиях или чрезмерного использования — процесса, который обычно делает батарею бесполезной из-за необратимого повреждения химических соединений, которые делают возможным процесс заряда / разряда.
Это отказоустойчивый переключатель или датчик, предназначенный для предотвращения перегрева батареи в экстремальных условиях или чрезмерного использования — процесса, который обычно делает батарею бесполезной из-за необратимого повреждения химических соединений, которые делают возможным процесс заряда / разряда.
Процесс зарядки
Литиевые батареи стали предпочтительными для портативных технологий благодаря их высокой плотности энергии и перезаряжаемым качествам.
Во время процесса зарядки ионы лития перемещаются через электролит от положительного электрода из оксида лития-кобальта к отрицательному графитовому электроду.При разряде или использовании ионы возвращаются через электролит, от отрицательного к положительному. Этот процесс происходит при относительно высоком напряжении — 3,7 вольт по сравнению с щелочной батареей AA при 1,5 вольт — вот почему литиевые батареи стали предпочтительным портативным источником питания для многих потребительских электронных устройств.
Этот процесс происходит при относительно высоком напряжении — 3,7 вольт по сравнению с щелочной батареей AA при 1,5 вольт — вот почему литиевые батареи стали предпочтительным портативным источником питания для многих потребительских электронных устройств.
Литиевые батареи также входят в состав более крупных аккумуляторных блоков, таких как аккумулятор для ноутбука. Эти аккумуляторные блоки содержат ряд литий-ионных элементов, связанных в один более крупный компонент, и будут содержать ряд дополнительных компонентов:
Эти аккумуляторные блоки содержат ряд литий-ионных элементов, связанных в один более крупный компонент, и будут содержать ряд дополнительных компонентов:
- Датчик температуры : Датчик, контролирующий температуру внутри упаковки в попытке сохранить безопасность и долговечность ячеек.
- Регулятор напряжения : Датчик и схема для контроля и регулирования выходной мощности / емкости каждой ячейки внутри блока
- Состояние заряда аккумулятора : Датчик, информирующий операционную систему о текущем состоянии заряда (например, на 47%)
- Разъем : Разъем для портативного компьютера, зависит от марки.

Литиевые батареи могут выполнить тысячи циклов заряда / разряда, прежде чем качество элемента начнет действительно ухудшаться, но есть несколько способов испортить батарею, потенциально подвергая себя опасности.
Обслуживание батарей
Положительный электрод, используемый в большинстве литиевых батарей, LiCoO 2 , может представлять ряд опасностей в случае повреждения элемента.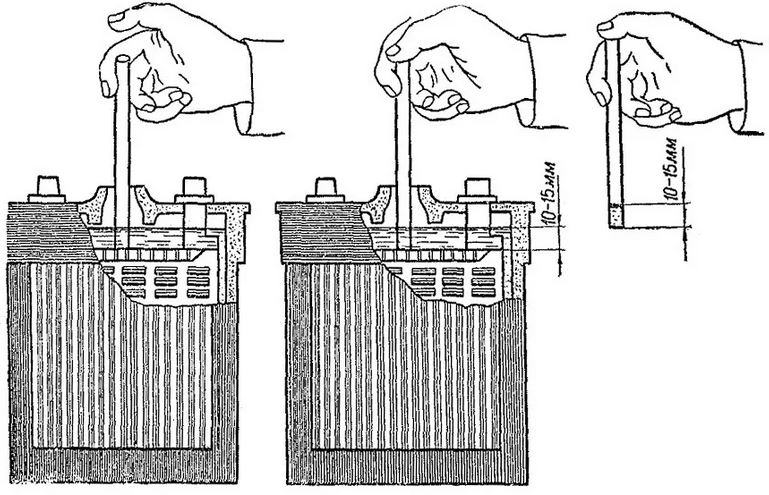 В отличие от ряда других вариантов батарей, использование горючего компаунда под давлением может привести к экстремальным результатам. Чтобы уменьшить это, элементы литиевых батарей подвергаются ряду испытаний на безопасность, многие из которых более строгие, чем их аналоги на основе кислоты.
В отличие от ряда других вариантов батарей, использование горючего компаунда под давлением может привести к экстремальным результатам. Чтобы уменьшить это, элементы литиевых батарей подвергаются ряду испытаний на безопасность, многие из которых более строгие, чем их аналоги на основе кислоты.
Тепло
Было несколько случаев воспламенения литиевых батарей в условиях экстремальной жары.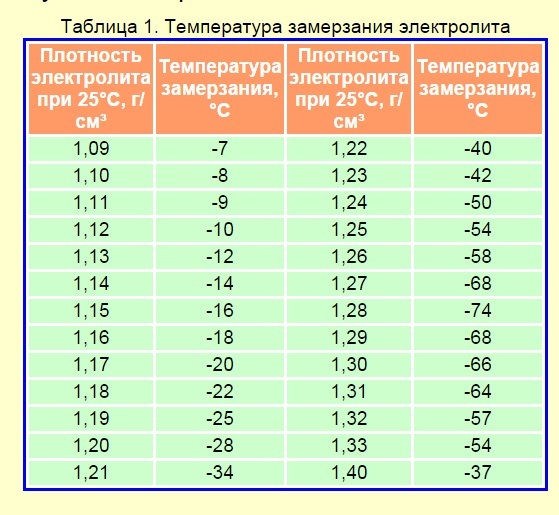 Батареи под воздействием тепла в сочетании с любым дополнительным, неожиданным давлением или коротким замыканием могут «взорваться», оставив разрушенную батарею и, чаще всего, поврежденную часть портативной техники.
Батареи под воздействием тепла в сочетании с любым дополнительным, неожиданным давлением или коротким замыканием могут «взорваться», оставив разрушенную батарею и, чаще всего, поврежденную часть портативной техники.
Каждая литиевая батарея имеет встроенный сепаратор внутри элемента. Это различает положительный и отрицательный электроды в процессе заряда / разряда. Если этот разделитель будет перфорирован или поврежден, существует вероятность контакта электродов. Это приводит к быстрому нагреву аккумулятора, что может привести к взрыву.
Это различает положительный и отрицательный электроды в процессе заряда / разряда. Если этот разделитель будет перфорирован или поврежден, существует вероятность контакта электродов. Это приводит к быстрому нагреву аккумулятора, что может привести к взрыву.
Батарея имеет вентиляционный механизм, чтобы предотвратить такое происшествие, но, в конечном счете, из-за природы удаляемого химического соединения, вероятность взрывной реакции все еще сохраняется из-за тепла, выделяемого химической реакцией.
Номинальные значения разряда
Литиевые батареи предпочитают частичный разряд, а не «глубокий» или «полный».У них нет зарядной памяти, поэтому частичный разряд не повлияет на будущую производительность.
Однако «глубокая» разрядка i.е. полный разряд батареи вызовет падение напряжения литиевой батареи и может привести к необратимому повреждению батареи.
Процесс старения
Литиевые батареи стареют.Предполагается, что их максимальный срок службы составляет от 2 до 4 лет в зависимости от количества циклов заряда / разряда. Это не означает, что вам следует отслеживать количество раз, когда вы используете батарею, поскольку это было бы довольно сложно. Но отказ от использования новой батареи и оставление ее на полке не продлит срок службы батареи — батареи все равно прослужат те же 2-4 года.
Также стоит проверить, когда была произведена батарея, при покупке нового портативного технического продукта.Если он простаивал на складе в течение года, срок службы батареи уже истощился. Свяжитесь с производителем продукта и по возможности попросите новую батарею.
Существуют современные приложения для управления батареями, которые утверждают, что могут со временем обратить вспять текущую приемлемую деградацию ячеек, например, batteryOS, продукт, который будет запущен в феврале 2015 года.
Li-Air
В литиевых батареях следующего поколения будет использоваться химический состав литий-воздух, обеспечивающий чрезвычайно высокую плотность энергии во все более легких конструкциях.Литий-воздушные аккумуляторы получают преимущество в плотности энергии по сравнению с традиционными аналогами за счет использования большого количества кислорода для индукции тока, вместо того, чтобы хранить необходимый химический окислитель внутри.
К сожалению, до того, как коммерчески жизнеспособный продукт Li-Air появится в наших портативных устройствах, все еще необходимы исследования в ряде ключевых областей.
Помогло ли это вам разобраться в батареях ваших портативных устройств? Дайте нам знать, что вы думаете ниже!
Кредиты на изображения: Батареи через Wikimedia Commons, Voltaic Pile через Wikimedia Commons, Литий-ионные батареи через Wikimedia Commons, Литий-полимерные батареи через Wikimedia Commons, 3GS со сломанной батареей через Wikimedia Commons, Пустая батарея через Pixabay, Плотность энергии батареи через Wikimedia Commons
7 подземных торрент-сайтов для получения контента без цензурыВам нужны специализированные поисковые машины, чтобы найти легальные торренты, закрытые дома, публичные записи и даже НЛО.Войдите в даркнет.
Об авторе Гэвин Филлипс (Опубликовано 605 статей)Гэвин — младший редактор отдела Windows and Technology Explained, постоянный участник Really Useful Podcast и редактор дочернего сайта MakeUseOf, посвященного криптографии, Blocks Decoded.У него есть степень бакалавра (с отличием) в области современного письма с использованием методов цифрового искусства, разграбленных на холмах Девона, а также более десяти лет профессионального писательского опыта. Он любит много пить чая, настольные игры и футбол.
Ещё от Gavin PhillipsПодпишитесь на нашу рассылку новостей
Подпишитесь на нашу рассылку, чтобы получать технические советы, обзоры, бесплатные электронные книги и эксклюзивные предложения!
Еще один шаг…!
Пожалуйста, подтвердите свой адрес электронной почты в письме, которое мы вам только что отправили.

 Уровень заряда на холостом ходу и при перегазовках не должен превышать 14,8 В. Если вы заметили на корпусе потеки и окисление на металлических поверхностях вблизи батареи, после устранения причины неисправности обязательно проверьте уровень и плотность электролитической жидкости. Продолжительная эксплуатация АКБ при перезаряде опасна оголением пластин, вследствие чего они нагреваются и теряют активную массу, происходит реакция сульфатации. На внутренней части пробок при этом можно увидеть темный налет. Лучше не пытаться оживить батарею доливкой электролита, а заменить аккумулятор.
Уровень заряда на холостом ходу и при перегазовках не должен превышать 14,8 В. Если вы заметили на корпусе потеки и окисление на металлических поверхностях вблизи батареи, после устранения причины неисправности обязательно проверьте уровень и плотность электролитической жидкости. Продолжительная эксплуатация АКБ при перезаряде опасна оголением пластин, вследствие чего они нагреваются и теряют активную массу, происходит реакция сульфатации. На внутренней части пробок при этом можно увидеть темный налет. Лучше не пытаться оживить батарею доливкой электролита, а заменить аккумулятор.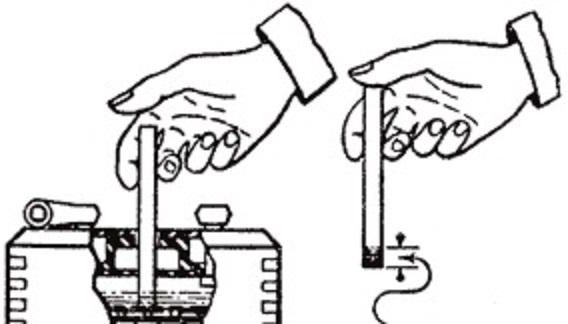
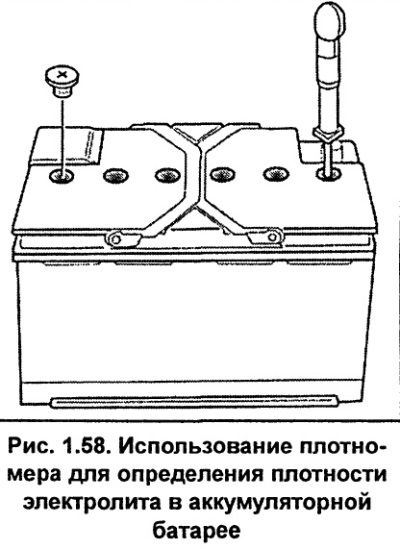
 Ареометр аккуратно опустить в первую банку и извлечь резиновой грушей электролит. Поплавок прибора должен находиться в свободном положении и не задевать дно и стенки банки.
Ареометр аккуратно опустить в первую банку и извлечь резиновой грушей электролит. Поплавок прибора должен находиться в свободном положении и не задевать дно и стенки банки. При добавлении в воду кислота реагирует не агрессивно, исключив ожоги и испарения. Кислота погружается в толщу воды и разбрызгивания не происходит из-за определенной реакции.
При добавлении в воду кислота реагирует не агрессивно, исключив ожоги и испарения. Кислота погружается в толщу воды и разбрызгивания не происходит из-за определенной реакции.